
| A、X与Y形成化合物时,X显负价,Y显正价 |
| B、X的第一电离能大于Y |
| C、X的原子序数小于Y |
| D、气态氢化物的稳定性X强于Y |


科目:高中化学 来源: 题型:
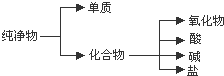
查看答案和解析>>
科目:高中化学 来源: 题型:
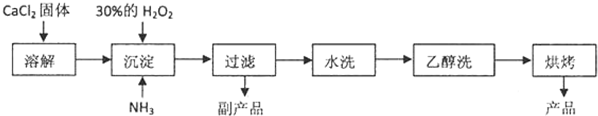
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液10mL,测溶液的pH | pH试纸变红(约为4) |
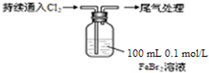 | ⅰ.开始通入100mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
| 试管 | 操作 | 现象 | 结论 |
| a | 取2mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 | Cl2的氧化性强于Fe3+ | |
| b | 取2mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 | |
| c | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
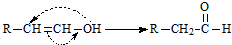 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系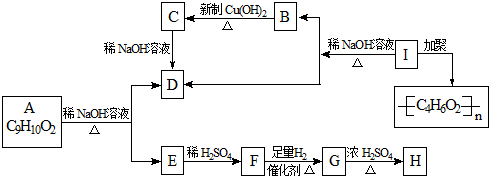
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
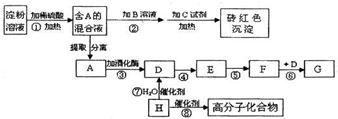
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥ | B、①③⑥⑦ |
| C、②④⑤⑧ | D、②⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
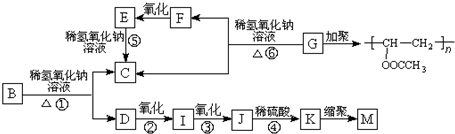
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com