
某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,则下列说法不正确的是
( )
A.Cl2是该反应的氧化产物
B.氧化剂和被氧化的还原剂的物质的量之比为1∶14
C.当转移0.2 mol电子时,被氧化的还原剂的物质的量为0.2 mol
D.由该反应可知还原性:HCl>CrCl3
科目:高中化学 来源: 题型:
A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三种原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素的最高正价与最低负价的代数和为4。
请回答下列问题:
(1)元素C在元素周期表中的位置是 ,元素D是 (填元素符号)。元素E是 (填名称),五种元素中离子半径最小的是 (写离子符号)。
(2)C, D, E三种元素最高价氧化物对应水化物的酸性由强到弱的顺序
为 (填化学式)。
(3)写出A和E两元素与最高价氧化物对应水化物反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某硫原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为
②m g该硫原子的物质的量为 mol
mol
③该硫原子的摩尔质量是aNA g
④a g该硫原子所含的电子数为16NA
A.①③ B.②④
C.①② D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.(新课标全国高考)常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
B.(山东高考)化合反应均为氧化还原反应
C.(山东高考)电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
D.(福建高考)易燃试剂与强氧化性试剂分开放置并远离火源
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生如下离子反应(未配平):
Mn2++S2O +H2O→MnO
+H2O→MnO +SO
+SO +H+;
+H+;
①该反应常用于检验Mn2+的存在,其特征现象是
________________________________________。
②若反应中有0.1 mol还原剂参加反应,则转移电子数为________NA,消耗氧化剂的物质的量_____________________________________mol。
③写出该反应的离子方程式_________________________________。
(2)①向CuSO4溶液中通入硫化氢生成黑色沉淀CuS的离子方程式为
__________________________________________________;
②向FeCl3溶液中加入过量的碘化钠溶液的离子方程式为_____________。
(3)在碱性介质中,H2O2有较强的还原性,可与Ag2O反应,该反应中氧化剂与还原剂的物质的量之比为_______________________________________。
(4)为测定大气中的臭氧(O3)含量,将0℃、1.01×105 Pa的空气V L慢慢通入足量KI溶液,使臭氧完全反应;然后将所得溶液用a mL c mol·L-1的Na2S2O3溶液进行滴定,恰好达到终点。已知:2Na2S2O3+I2===Na2S4O6+2NaI。
①该滴定过程中可选择的指示剂为________。
②O3与KI溶液反应生成两种单质,则反应的化学方程式为
________________________________________________________。
③空气中臭氧的体积分数为________(用含“a、c、V”的字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
同周期主族元素,随原子序数递增,下列说法中错误的是
A.最外层电子数逐渐增多 B.元素最高正化合价均由+1递增到+7
C.原子半径逐渐减小 D.金属性逐渐减弱,非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
加强空气质量检测,客观分析空气中污染物的来源及性质,将有助于制定有针对性的治理措施。下表是某城市某日的空气质量报告:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用下图所示装置进行实验。
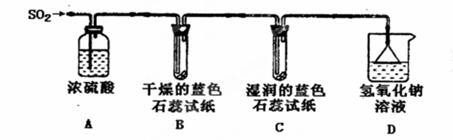
①A装置的作用是____________________。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊
试纸变成________________色,说明SO2与水反应生成一种酸,其化学反应方程式是 。
③D装置的作用是__________________________________________________,
D中发生反应的化学方程式是_________________________________________。
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH________7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐_______(填“变大”或“变小”), 直至恒定,原因是 (写出反应的离子方程式)。
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4, 则在此过程中的飘尘是作为___________(填“催化剂”或“氧化剂”)。
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为__________________,是造成酸雨的另一主要原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于A(g)+2B(g)===3C(g)的化学反应,下列表示的反应速率最大的是( )
A.v(A)=0.6mol/(L·min) B.v(B)=1.2mol/(L·min)
C.v(C)=1.2mol/(L·min) D.v(B)=0.03mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com