
 (任写一种).
(任写一种).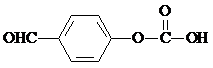 或
或 .
.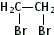
分析 由合成H的路线图可知,反应①是酚羟基临位上的溴代反应,反应②是甲基上的卤代反应,反应③是取代反应,生成酯基,反应④是去掉苯环上的溴原子,反应⑤是在苯环上引入-CH2Cl,因为苯环上有两个空位,所以F可能存在同分异构体,反应⑥是使-CH2Cl生成-CH3的反应,反应⑦是在苯环的另一个空位上引入(CH3)2C=CHCH2-;以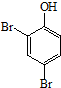 、HCHO为原料制备
、HCHO为原料制备 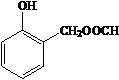 ,需先在酚羟基的临位引入-CH2Cl,在水解生成-OH,去掉Br,醛基与甲酸酯化生成
,需先在酚羟基的临位引入-CH2Cl,在水解生成-OH,去掉Br,醛基与甲酸酯化生成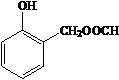 ,据此分析.
,据此分析.
解答 解:(1)由A的结构简式可知,其含有的官能团有酚羟基、酯基,故答案为:酚羟基、酯基;
(2)反应③是取代反应,生成酯基和CH2CH2Br,故答案为:取代反应;
(3)反应⑦是在苯环的另一个空位上引入(CH3)2C=CHCH2CH2-,还得到HBr,说明是G与(CH3)2C=CHCH2Br发生取代反应,
故答案为:(CH3)2C=CHCH2Br;
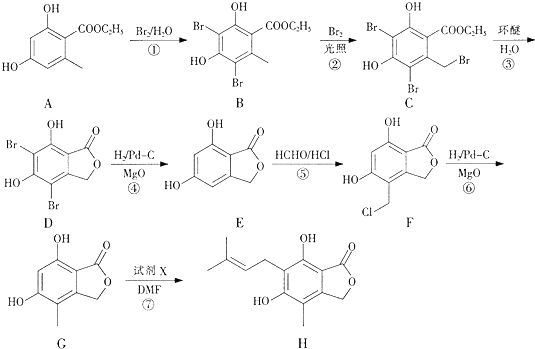
(4)反应⑤是在苯环上引入-CH2Cl,因为苯环上有两个空位,所以F可能存在同分异构体 ,
,
故答案为: ;
;
(5)E除苯环外还有4个氧原子2个碳原子,E的同分异构体可以发生银镜反应,说明含有醛基,能够与NaHCO3反应产生CO2,说明含有羧基,是芳香族化合物,且核磁共振氢谱图显示分子中有4种不同化学环境的氢,说明羧基和醛基在对位,E的同分异构体为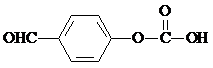

故答案为: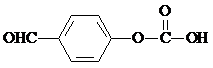

(6)以 、HCHO为原料制备
、HCHO为原料制备 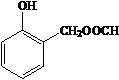 ,需先在酚羟基的临位引入-CH2Cl,在水解生成-OH,去掉Br,醛基与甲酸酯化生成
,需先在酚羟基的临位引入-CH2Cl,在水解生成-OH,去掉Br,醛基与甲酸酯化生成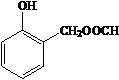 ,合成路线流程图为:
,合成路线流程图为:
故答案为: .
.
点评 本题考查了有机物的推断,根据各物质的结构采用正逆结合的方法进行推断,推断时要根据反应条件结合解答,为高考热点题型,要注意以教材为原型采用知识迁移的方法进行分析解答问题,题目难度不大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 硅酸钠溶液与足量CO2反应:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2中含有32NA个电子 | |
| B. | 22.4L N2含有阿伏加德罗常数个氮分子 | |
| C. | 在标准状况下,22.4L水的质量约为18g | |
| D. | 常温常压下22g的CO2与标准状况下11.2L HCl含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①中阳极处能产生使湿润淀粉KI试纸变蓝的气体 | |
| B. | ②中待镀铁制品应与电源正极相连 | |
| C. | ③中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法 | |
| D. | ④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| 平行测定数据 | 平均值 | ||||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com