
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B、沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+ |
| C、向反应后的溶液加入乙醇,溶液将会没有发生任何变化,因[Cu(NH3)4]2+不会与乙醇发生反应 |
| D、在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B、将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C、用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切 |
| D、用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:
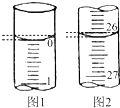 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | ① | ② |
| 第二次 | 25.00 | 1.56 | 27.68 | 26.12 |
| 第三次 | 25.00 | 0.22 | 26.30 | 26.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ |
| B、0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ |
| C、0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度30℃ |
| D、0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
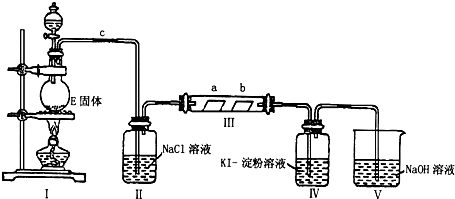
 某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应该使用萃取的方法,并选用酒精作萃取剂 |
| B、萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 |
| C、静置分层后碘单质一定溶在上层液体中,应从分液漏斗的上口倒出 |
| D、从分液漏斗中分离出的就是纯净的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下,将pH=11的氨水和pH=3的盐酸,等体积混合后,所得溶液中各离子浓度的关系是c(Cl-)>c(NH
| ||
| B、某二元酸在水中的电离方程式为:H2B═H++HB-,HB-?H++B2-,所以NaHB溶液呈酸性 | ||
| C、在BaSO4饱和溶液中加入少量的BaCl2溶液产生沉淀,平衡后的溶液中:C(Ba2+)?C(SO42-)>Ksp;c(Ba2+)>C(SO42-) | ||
| D、等浓度的NH3?H2O、NH4HSO4,NH4Cl溶液中c(NH4+)在逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com