
【题目】I.如图转化关系所示(部分反应物略去):组成单质丁的元素存在三种核素,其中一种核素没有中子。三种核素中质量数最大的原子可表示为__________
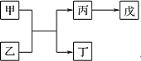
(1)由组成单质丁的元素与另一种元素形成的三核 10电子微粒所构成的物质的用途__________________________
(2)乙为 NaOH,若戊为不溶于强酸,但溶于强碱的沉淀物,则甲乙反应时作氧化剂的是__________________
(3)丙→戊反应的化学方程式为_______________________
(4)若戊为既能溶于强酸又能溶于强碱的沉淀物,则甲和乙反应的离子方程式为____________________
II.A、B、C、D 是原子序数依次增大的五种短周期主族元素,其中 A 的原子序数是 B 和 D 原子序数之和的 1/4,C 元素的单质能在A 元素最高价氧化物中燃烧,甲和丙是 D 元素的两种常见氧化物,乙和丁是 B 元素的两种常见同素异形体,1 L 0.005mol·L-1 戊溶液中含 H+ 0.01mol。它们之间的转化关系仍如上图所示(部分反应物省略),
(5)B、C 的元素符号分别是____________________、___________________________其甲和乙反应生成丙和丁的化学方程式为_________________________。
【答案】T 做溶剂 H2O 或水 Na2SiO3 +2HCl = 2NaCl + H2SiO3↓ 2Al+2OH-+6H2O ==2[Al(OH)4]-+3H2↑ O Mg (7). SO2+O3=SO3+ O2
【解析】
I.组成单质丁的元素存在三种核素,其中一种核素没有中子,丁是H2;H元素与另一种元素形成的三核 10电子微粒是H2O;若戊为不溶于强酸,但溶于强碱的沉淀物,则戊为H2SiO3、甲为Si、丙为Na2SiO3;若戊为既能溶于强酸又能溶于强碱的沉淀物,则戊为Al(OH)3、甲为Al、丙为Na[Al(OH)4];
II.1 L 0.005mol·L-1 戊溶液中含 H+ 0.01mol,则戊为H2SO4;甲和丙是D元素的两种常见氧化物,可知丙为SO3,甲为SO2,乙和丁是B元素的两种常见同素异形体,乙为O3,丁为O2,则B为O元素,D为S元素, A的原子序数是B和D原子序数之和的![]() ,A的原子序数为(8+16)×
,A的原子序数为(8+16)×![]() =6,可知A为C元素;C 元素的单质在CO2中燃烧,C是Mg元素。
=6,可知A为C元素;C 元素的单质在CO2中燃烧,C是Mg元素。
I.组成单质丁的元素存在三种核素,其中一种核素没有中子,丁是H2,氢元素的三种核素中质量数最大是3,该原子可表示为T;
(1)H元素与另一种元素形成的三核 10电子微粒是H2O,水常做溶剂;
(2)若戊为不溶于强酸,但溶于强碱的沉淀物,则戊为H2SiO3、甲为Si、丙为Na2SiO3;则甲乙反应的方程式是Si+2NaOH+H 2 O=Na 2SiO 3+2H 2↑,水中氢元素化合价降低,作氧化剂的是水;
(3)Na2SiO3和盐酸反应生成硅酸沉淀和氯化钠,反应的化学方程式为Na2SiO3 +2HCl = 2NaCl + H2SiO3↓;
(4)若戊为既能溶于强酸又能溶于强碱的沉淀物,则戊为Al(OH)3、甲为Al、丙为Na[Al(OH)4];则铝和氢氧化钠反应生成四羟基合铝酸钠与氢气,反应的离子方程式为2Al+2OH-+6H2O === 2[Al(OH)4]-+3H2↑;
(5)根据以上分析,B、C 的元素符号分别是O、Mg;甲为SO2、乙为O3,SO2和O3反应生成SO3和O2,反应的化学方程式为SO2+O3=SO3+ O2;


科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H<0。已知1100℃时K=0.263。
Fe(s)+CO2(g) △H<0。已知1100℃时K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值___,平衡常数K值___(增大、减小或不变)
(2)1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态____(“是”或“否”),此时,化学反应速率是υ正__υ逆(大于、小于或等于),其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是

A.工业上通过电解熔融的WX来制得W
B.W、X对应的简单离子半径顺序为:W>X
C.Y的最高价氧化物对应水化物为弱酸
D.该漂白剂中各元素均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]()
![]() ,起始加入量
,起始加入量![]() 为
为![]() ,
,![]() 为
为![]() ,HCOOH为
,HCOOH为![]() ,在一定温度下,不同时刻甲酸乙酯的物质的量如下:
,在一定温度下,不同时刻甲酸乙酯的物质的量如下:![]() 注:本题速率单位用
注:本题速率单位用![]() 表示
表示![]()
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
|
|
|
|
|
|
|
|
|
|
|
|
|
下列说法不正确的是 ![]()
![]()
A.以表中![]() 为单位,
为单位,![]() 内最大的平均反应速率在
内最大的平均反应速率在![]() 之间
之间
B.前![]() 甲酸乙酯的平均反应速率为
甲酸乙酯的平均反应速率为![]()
C.甲酸乙酯的反应速率先增大后减小的原因是该反应放热
D.开始时若加适量的NaOH,也可以加快甲酸乙酯水解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将6 mol CO2和8 mol H2充入2 L密闭容器中发生反应CO2(g) +3H2(g)CH3OH(g) + H2O(g) ΔH < 0,容器中H2的物质的量随时间的变化关系如图中的实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系。下列说法正确的是
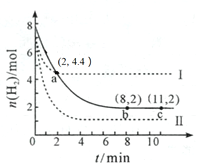
A.曲线Ⅰ对应的条件改变可能降低温度
B.曲线Ⅱ对应的条件改变可能是充入氦气
C.该温度下,此反应的化学平衡常数的数值为0.5
D.从反应开始至a 点,ν(CO2) = 0.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝在生产生活中有广泛的应用。回答下列问题:
(1)铝的原子结构示意图为___。它位于元素周期表的第___周期,第___族。
(2)除去铁粉中混有的少量铝粉,可以加入足量的___溶液,充分反应后过滤、洗涤、烘干,反应的化学方程式为___。
(3)实验室制备氢氧化铝的常用方法是在氯化铝溶液中滴加氨水,反应的离子方程式为___。
(4)常温下,铁跟水不反应,但红热的铁会跟水蒸气发生反应,反应的化学方程式为___。
(5)检验某溶液中是否含有Fe3+的操作方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲使用 450 mL 0.2 molL-1 CuSO4 溶液,配制该溶液包含以下步骤:
①称取一定质量胆矾(CuSO45H2O)、放入烧杯,用适量蒸馏水将其完全溶解;
②把溶液小心地注入容量瓶中;
③继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm 时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3 次,每次洗涤液都转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀。
请填写下列空白:
(1)应该称取胆矾的质量是_________。
(2)上述操作的正确顺序是_________。
(3)实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒__________等。
(4)下列情况中会导致所配溶液浓度偏小的是_________(填序号)。
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用胶头滴管小心地吸去超出部分,使凹液面底部与刻度线相切
(5)取 100 mL 所配溶液,向其中加入 1.68 g 铁粉,充分反应后,过滤,将固体洗涤、干燥后,再加入1 molL-1 稀硫酸至固体不再溶解。
试计算:
①至少需要稀硫酸 _________mL。
②固体溶解过程中产生氢气_________mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
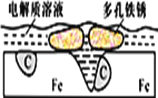
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com