
【题目】1L某混合溶液中,溶质X,Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X,Y,Z分别是( ) 
A.AlCl3、FeCl3、NaOH
B.AlCl3、MgCl2、NaOH
C.NaAlO2、Ba(OH)2、H2SO4
D.NaAlO2、BaCl2、H2SO4
【答案】C
【解析】解:A.若X、Y、Z分别为氯化铝、氯化铁、氢氧化钠,开始滴入氢氧化钠时,Al3++3OH﹣=Al(OH)3↓,Fe3++3OH﹣=Fe(OH)3↓,n(Al3+):n(OH﹣)=1:3,n(Fe3+):n(OH﹣)=1:3,继续滴加Al(OH)3+OH﹣=AlO2﹣+2H2O,n(Al(OH)3):n(OH﹣)=1:1,不符合图象的数值变化,故A错误;
B.若X、Y、Z分别为氯化铝、氯化镁、氢氧化钠,开始滴入氢氧化钠时,Mg2++2OH﹣=Mg(OH)2↓,Al3++3OH﹣=Al(OH)3↓,n(Mg2+):n(OH﹣)=1:2,n(Al3+):n(OH﹣)=1:3,继续滴加Al(OH)3+OH﹣=AlO2﹣+2H2O,n(Al(OH)3):n(OH﹣)=1:1,不符合图象的数值变化,故B错误;
C.若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,开始滴入硫酸时OH﹣+H+=H2O,Ba2++SO42﹣=BaSO4↓,
H++AlO2﹣+H2O=Al(OH)3↓,
图中第一段直线:氢氧化钡的OH﹣和硫酸里的H+1:1中和,同时Ba2+和SO42﹣1:1反应生成硫酸钡沉淀,
Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O;
图中第二段直线氢氧化钡消耗完,硫酸继续滴加,氢离子开始和偏铝酸根离子反应H++AlO2﹣+H2O=Al(OH)3↓,硫酸的消耗量(硫酸消耗量是氢离子消耗量的一半)和沉淀的生成量是1:2;
图中第三段直线:硫酸进一步过量,开始消耗沉淀,Al(OH)3+3H+=Al3++3H2O硫酸和沉淀消耗量应为1.5:1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4 , 以上三段符合图象的数值变化,故C正确;
D.若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,滴入硫酸时Ba2++SO42﹣=BaSO4↓,H++AlO2﹣+H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.05mol,需要硫酸0.05mol,图中第一段直线不符合,故D错误;
故选C.
根据图象分析,若Z为氢氧化钠溶液,Mg2++2OH﹣=Mg(OH)2↓,Al3++3OH﹣=Al(OH)3↓,Fe3++3OH﹣=Fe(OH)3↓,Al(OH)3+OH﹣=AlO2﹣+2H2O,溶液中沉淀量达到最大时,生成氢氧化铝沉淀、氢氧化铁沉淀、氢氧化镁沉淀时沉淀物质的量和消耗的碱的物质的量不符合,X不能是铝盐;所以Z是硫酸溶液,据此解答.


科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
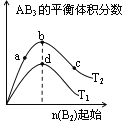
A. 若![]() >
>![]() ,则正反应一定是放热反应
,则正反应一定是放热反应
B. 在![]() 和
和![]() 不变时达到平衡,
不变时达到平衡, ![]() 的物质的量大小为:
的物质的量大小为:
c>b>a
C. 若![]() >
>![]() ,达到平衡时b、d点的反应速率为
,达到平衡时b、d点的反应速率为![]() >
>![]()
D. 达到平衡时A2的转化率大小为:b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
A.Cl-、Mg2+、H+、Cu2+、SO42-B.Na+、Ba2+、NO3-、OH-、SO42-
C.K+、NO3-、SO42-、H+、Na+D.MnO4-、K+、Cl-、H+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeCl2溶液常含有Fe3+ , 为检验Fe3+可选用下列哪种试剂( )
A.稀H2SO4
B.NaCl溶液
C.KSCN溶液
D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是
A. 实验使用的主要仪器是分液漏斗
B. 分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
C. 碘的四氯化碳溶液呈紫红色
D. 碘在四氯化碳中的溶解度比在水中的溶解度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F基态原子的核外电子排布式为______________________。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是___________(用元素符号回答)。
(3)元素B的简单气态氢化物的沸点___________(填“高于”或“低于”)元素A的简单气态氢化物的沸点,其主要原因是______________________。
(4)由A、B、C形成的离子CAB与AC2互为等电子体,则CAB的结构式为___________。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为___________。

(6)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com