
【题目】某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
A.Cl-、Mg2+、H+、Cu2+、SO42-B.Na+、Ba2+、NO3-、OH-、SO42-
C.K+、NO3-、SO42-、H+、Na+D.MnO4-、K+、Cl-、H+、SO42-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质判断,能设计成原电池(填“A”或“B”).
②如果(A或B)不能,说明其原因 .
(2)如图所示装置,烧杯中盛有滴有酚酞的NaCl饱和溶液,C(1)、C(2)为多孔石墨电极.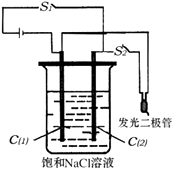
①接通S1后,两极均有气体生成,C(1)附近溶液显色.装置内发生的总反应化学方程式为 .
②若有11.7g NaCl发生反应,理论上生成Cl2的体积(标准状况)为 .
③反应一段时间后(电极未脱离液面),断开S1 , 接通S2 , 观察到二极管发光.此时:C(2)的电极反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液中,溶质X,Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X,Y,Z分别是( ) 
A.AlCl3、FeCl3、NaOH
B.AlCl3、MgCl2、NaOH
C.NaAlO2、Ba(OH)2、H2SO4
D.NaAlO2、BaCl2、H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂粉精暴露在潮湿的空气中易失效,其原因与下列叙述无关的是
A. HClO的酸性比H2CO3弱 B. Ca(ClO)2是盐
C. HClO见光易分解 D. Ca(ClO)2能与碳酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A2+3B2![]() 2AB3 以下表示的反应速率中,速率最大的是( )
2AB3 以下表示的反应速率中,速率最大的是( )
A. V(A2)=0.4 molL-1min-1 B. V(B2)=0.8 molL-1min-1
C. V(AB3)=0.6 molL-1min-1 D. V(A2)=0.01 molL-1S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,溶液的pH随溶液体积变化的曲线如图所示,则下列叙述正确的是
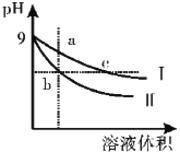
A. b、c两点溶液的导电能力b>c
B. 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb>Vc
C. c点溶液中c( H十)=c ( OH一)+c(CH3COOH)
D. a、b、c三点溶液中水的电离程度a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的__区;溴的价电子排布式为__.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是__.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是__.
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:

请比较二者酸性强弱:HIO3__ H5IO6(填“>”、“<”或“=”).
(5)已知ClO2﹣为角型,中心氯原子周围有四对价层电子.写出一个ClO2﹣的等电子体__.
(6)图3为碘晶体晶胞结构.有关说法中正确的是__.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com