
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的__区;溴的价电子排布式为__.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是__.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是__.
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:

请比较二者酸性强弱:HIO3__ H5IO6(填“>”、“<”或“=”).
(5)已知ClO2﹣为角型,中心氯原子周围有四对价层电子.写出一个ClO2﹣的等电子体__.
(6)图3为碘晶体晶胞结构.有关说法中正确的是__.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__.
【答案】 p 4s24p5 氢键 I < Cl2O、OF2等 AD ![]()
【解析】(1) 根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为4s24p5;(2)HF分子之间存在氢键,使氢氟酸分子缔合;(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子;(4)H5IO6(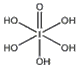 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3;(5)ClO2-中心氯原子的价层电子对数n=2+
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3;(5)ClO2-中心氯原子的价层电子对数n=2+![]() =4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等;(6)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,选项A正确;B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,选项B错误;C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,选项C错误;D.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,选项D正确;答案选AD;(7)该晶胞中含有钙离子个数=8×
=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等;(6)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,选项A正确;B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,选项B错误;C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,选项C错误;D.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,选项D正确;答案选AD;(7)该晶胞中含有钙离子个数=8×![]() +6×
+6×![]() =4,氟离子个数为8,则晶胞体积V=a3,CaF2密度为=
=4,氟离子个数为8,则晶胞体积V=a3,CaF2密度为=![]() =
=![]() =ρ,则CaF2的相对分子质量M=
=ρ,则CaF2的相对分子质量M=![]() 。
。


科目:高中化学 来源: 题型:
【题目】某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
A.Cl-、Mg2+、H+、Cu2+、SO42-B.Na+、Ba2+、NO3-、OH-、SO42-
C.K+、NO3-、SO42-、H+、Na+D.MnO4-、K+、Cl-、H+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列四种物质: A、次氯酸钙 B、碘酸钾 C、氨气 D、葡萄糖
请你根据题意,选择恰当的选项用字母代号填空
(1)能使湿润的红色石蕊试纸变蓝的是;
(2)漂白粉的有效成分是;
(3)加碘食盐中含有;
(4)人体内重要的供能物质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于加热的操作正确的是
A.给试管中的液体加热时,试管口不准对着别人,但可以对着自己
B.玻璃仪器都可以用于加热
C.用H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜
D.无论给试管中的液体还是固体加热,都必须先预热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F基态原子的核外电子排布式为______________________。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是___________(用元素符号回答)。
(3)元素B的简单气态氢化物的沸点___________(填“高于”或“低于”)元素A的简单气态氢化物的沸点,其主要原因是______________________。
(4)由A、B、C形成的离子CAB与AC2互为等电子体,则CAB的结构式为___________。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为___________。

(6)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料.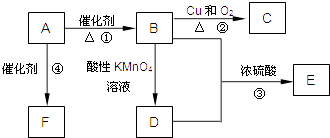
(1)A的结构式为 , C的名称为 .
(2)B分子中的官能团名称是 , 请设计一种验证B物质存在该官能团的方法 .
(3)写出下列反应的化学方程式并指出反应类型:①;反应类型是;
②;反应类型是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是
A.AgNO3 B.FeSO4 C.MgCl2 D.(NH4)2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CnHmCOOH所表示的羧酸0.1mol加成时需32g溴,0.1mol该羧酸完全燃烧,产生CO2和H2O共3.4mol,该羧酸是( )
A.C15H27COOH
B.C15H31COOH
C.C17H31COOH
D.C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
① 2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
② 4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③ 2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=________kJ/mol。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

① 由图A可判断T1 ________T2,该反应的△H________0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min)。
③ T2时该反应的平衡常数K=____________。
(4) 一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com