
【题目】以CnHmCOOH所表示的羧酸0.1mol加成时需32g溴,0.1mol该羧酸完全燃烧,产生CO2和H2O共3.4mol,该羧酸是( )
A.C15H27COOH
B.C15H31COOH
C.C17H31COOH
D.C17H33COOH
【答案】C
【解析】解:0.1mol加成时需32g溴,即n(Br2)= ![]() =0.2mol,说明分子中含有2个C=C键, A、C15H27COOH中含有2个C=C键,0.1mol该羧酸完全燃烧,产生CO2和H2O共(1.6+1.4)mol=3.0mol,故A错误;
=0.2mol,说明分子中含有2个C=C键, A、C15H27COOH中含有2个C=C键,0.1mol该羧酸完全燃烧,产生CO2和H2O共(1.6+1.4)mol=3.0mol,故A错误;
B、C15H31COOH为饱和酸,不含C=C键,故B错误;
C、C17H31COOH中含有2个C=C键,0.1mol该羧酸完全燃烧,产生CO2和H2O共(1.8+1.6)mol=3.4mol,故C正确;
D、C17H33COOH中含有1个C=C键,0.1mol该羧酸完全燃烧,产生CO2和H2O共(1.8+1.7)mol=3.5mol,故D错误.
故选C.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,溶液的pH随溶液体积变化的曲线如图所示,则下列叙述正确的是
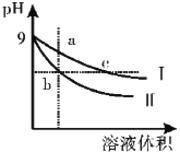
A. b、c两点溶液的导电能力b>c
B. 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb>Vc
C. c点溶液中c( H十)=c ( OH一)+c(CH3COOH)
D. a、b、c三点溶液中水的电离程度a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的__区;溴的价电子排布式为__.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是__.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是__.
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:

请比较二者酸性强弱:HIO3__ H5IO6(填“>”、“<”或“=”).
(5)已知ClO2﹣为角型,中心氯原子周围有四对价层电子.写出一个ClO2﹣的等电子体__.
(6)图3为碘晶体晶胞结构.有关说法中正确的是__.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理正确的是
A.金属Na着火,立即用水扑灭
B.实验结束后,用嘴吹灭酒精灯
C.皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗
D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为六种短周期元素的部分性质,下列有关说法错误的是( )
元素代号 | X | Y | Z | Q | R | T |
原子半径/10﹣10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
主要化合价 | +4、﹣4 | ﹣2 | +5、﹣3 | +4、﹣4 | +7、﹣1 | +5、﹣3 |
A.X与Y可以形成阴离子XY ![]()
B.元素R的氧化物对应水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物QX和XR4 , 其晶体类型不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式中,正确的是( )
A.烧碱加入醋酸溶液OH﹣+CH3COOH═CH3COO﹣+H2O
B.盐酸与小苏打溶液反应2H++CO ![]() ═CO2↑+H2O
═CO2↑+H2O
C.氢氧化钡溶液中加入稀硫酸:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
D.金属钠与水反应Na+2H2O═Na++2OH﹣+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是

A. 由图中信息可知,HA一定是强酸
B. 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1
C. N点对应的溶液中c(M+)=c(A-)
D. K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com