
ЁОЬтФПЁПбЧЯѕЫсТШ(C1NO)ЪЧгаЛњКЯГЩжаЕФживЊЪдМСЁЃПЩгЩNOгыCl2дкЭЈГЃЬѕМўЯТЗДгІЕУЕНЃЌЛЏбЇЗНГЬЪНЮЊ2NO(g)+C12(g)![]() 2C1NO(g)ЃЌ
2C1NO(g)ЃЌ
ЃЈ1ЃЉЕЊбѕЛЏЮягыаќИЁдкДѓЦјжаЕФКЃбЮСЃзгЯрЛЅзїгУЪБЛсЩњГЩбЧЯѕЫсТШЃЌЩцМАШчЯТЗДгІЃК
Ђй 2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
Ђк 4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
Ђл 2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
дђK1ЃЌK2ЃЌK3жЎМфЕФЙиЯЕЮЊK3=______________ЁЃ
ЃЈ2ЃЉвбжЊМИжжЛЏбЇМќЕФМќФмЪ§ОнШчЯТБэ(бЧЯѕЫсТШЕФНсЙЙЮЊCl-N=O):

дђ2NO(g)+C12(g)![]() 2C1NO(g)ЗДгІЕФЁїHКЭaЕФЙиЯЕЮЊЁїH=________kJ/molЁЃ
2C1NO(g)ЗДгІЕФЁїHКЭaЕФЙиЯЕЮЊЁїH=________kJ/molЁЃ
ЃЈ3ЃЉдк1LЕФКуШнУмБеШнЦїжаГфШы2molNO(g)КЭ1molC12(g)ЃЌдкВЛЭЌЮТЖШЯТВтЕУc(C1NO)гыЪБМфЕФЙиЯЕШчЭМA:

Ђй гЩЭМAПЩХаЖЯT1 ________T2ЃЌИУЗДгІЕФЁїH________0 (ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)ЁЃ
Ђк ЗДгІПЊЪМЕН10minЪБNOЕФЦНОљЗДгІЫйТЪv(NO)=____________mol/(LЁЄmin)ЁЃ
Ђл T2ЪБИУЗДгІЕФЦНКтГЃЪ§K=____________ЁЃ
ЃЈ4ЃЉ вЛЖЈЬѕМўЯТдкКуЮТКуШнЕФУмБеШнЦїжаАДвЛЖЈБШР§ГфШыNO(g)КЭCl2(g)ЃЌЦНКтЪБClNOЕФЬхЛ§ЗжЪ§Ыцn(NO)/n(C12)ЕФБфЛЏЭМЯѓШчЭМBЃЌдђAЁЂBЁЂCШ§зДЬЌжаЃЌNOЕФзЊЛЏТЪзюДѓЕФЪЧ________ЕуЁЃ
ЁОД№АИЁП K12/K2 289-2a < < 0.1 2 A
ЁОНтЮіЁПЪдЬтЗжЮіЃКЃЈ1ЃЉвбжЊЃКЂй2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)
NaNO3(s)+ClNO(g)
Ђк 4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
ИљОнИЧЫЙЖЈТЩПЩжЊНЋЂйЁС2-ЂкПЩЕУЃК2NO(g)+Cl2(g)![]() 2ClNO(g)ЃЌвђДЫИУЗДгІЕФЦНКтГЃЪ§K3ЃНK12/K2ЁЃ
2ClNO(g)ЃЌвђДЫИУЗДгІЕФЦНКтГЃЪ§K3ЃНK12/K2ЁЃ
ЃЈ2ЃЉ2NO(g)+C12(g)![]() 2C1NO(g)ЗДгІЕФЁїH=ЗДгІЮяЕФМќФмжЎКЭ-ЩњГЩЮяЕФМќФмжЎКЭ=(2ЁС630+243) kJ/mol-(2a+2ЁС607) kJ/molЃН(289-2a)kJ/molЁЃ
2C1NO(g)ЗДгІЕФЁїH=ЗДгІЮяЕФМќФмжЎКЭ-ЩњГЩЮяЕФМќФмжЎКЭ=(2ЁС630+243) kJ/mol-(2a+2ЁС607) kJ/molЃН(289-2a)kJ/molЁЃ
ЃЈ3ЃЉЂй ИљОнЭМЯёПЩжЊT2ЃОT1ЃЌНЕЕЭЮТЖШc(C1NO)діДѓЃЌЫЕУїЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌЫЕУїе§ЗДгІЪЧЗХШШЗДгІЃЌЁїHЃМ0ЁЃ
Ђк ЗДгІПЊЪМЕН10minЪБЃЌc(C1NO)=1mol/LЃЌдђv(C1NO)= 1mol/LЁТ10min=0.1mol/(LЁЄmin)ЃЌдђNOЕФЦНОљЗДгІЫйТЪv(NO)=v(C1NO)=0.1mol/(LЁЄmin)
Ђл 2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
Ц№ЪМ(mol/L) 2 1 0
ЗДгІ(mol/L) 1 0.5 1
ЦНКт(mol/L) 1 0.5 1
ЫљвдT2ЪБИУЗДгІЕФЦНКтГЃЪ§K=![]() =12/12ЁС0.5=2ЁЃ
=12/12ЁС0.5=2ЁЃ
ЃЈ4ЃЉn(NO)/n(C12)ЕФБШжЕдНаЁЃЌЫЕУїШєn(NO)ВЛБфЃЌn(C12) дНДѓЃЌЫљвдNOЕФзЊЛЏТЪдНДѓЃЌNOЕФзЊЛЏТЪзюДѓЕФЪЧAЕуЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдЙшдхЭСЮЊдиЬхЕФЮхбѕЛЏЖўЗАЃЈV2O5ЃЉЪЧНгДЅЗЈЩњВњСђЫсЕФДпЛЏМСЁЃДгЗЯЗАДпЛЏМСжаЛиЪеV2O5МШБмУтЮлШОЛЗОГгжгаРћгкзЪдДзлКЯРћгУЁЃЗЯЗАДпЛЏМСЕФжївЊГЩЗжЮЊЃК
ЮяжЪ | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
жЪСПЗжЪ§/% | 2.2ЁЋ2.9 | 2.8ЁЋ3.1 | 22ЁЋ28 | 60ЁЋ65 | 1ЁЋ2 | <1 |
вдЯТЪЧвЛжжЗЯЗАДпЛЏМСЛиЪеЙЄвеТЗЯпЃК
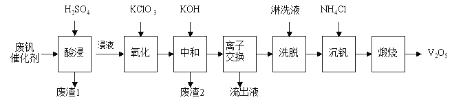
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЁАЫсНўЁБЪБV2O5зЊЛЏЮЊVO2+ЃЌЗДгІЕФРызгЗНГЬЪНЮЊ___________ЃЌЭЌЪБV2O4зЊГЩVO2+ЁЃЁАЗЯдќ1ЁБЕФжївЊГЩЗжЪЧ__________________ЁЃ
ЃЈ2ЃЉЁАбѕЛЏЁБжагћЪЙ3 molЕФVO2+БфЮЊVO2+ЃЌдђашвЊбѕЛЏМСKClO3жСЩйЮЊ____________molЁЃ
ЃЈ3ЃЉЁАжаКЭЁБзїгУжЎвЛЪЧЪЙЗАвдV4O124-аЮЪНДцдкгкШмвКжаЁЃЁАЗЯдќ2ЁБжаКЌга_____________ЁЃ
ЃЈ4ЃЉЁАРызгНЛЛЛЁБКЭЁАЯДЭбЁБПЩМђЕЅБэЪОЮЊЃК4ROH+![]()
![]() R4V4O12+4OHЃЈвдROHЮЊЧПМюадвѕРызгНЛЛЛЪїжЌЃЉЁЃЮЊСЫЬсИпЯДЭбаЇТЪЃЌСмЯДвКгІИУГЪ___________адЃЈЬюЁАЫсЁБЁАМюЁБЁАжаЁБЃЉЁЃ
R4V4O12+4OHЃЈвдROHЮЊЧПМюадвѕРызгНЛЛЛЪїжЌЃЉЁЃЮЊСЫЬсИпЯДЭбаЇТЪЃЌСмЯДвКгІИУГЪ___________адЃЈЬюЁАЫсЁБЁАМюЁБЁАжаЁБЃЉЁЃ
ЃЈ5ЃЉЁАСїГівКЁБжабєРызгзюЖрЕФЪЧ________ЁЃ
ЃЈ6ЃЉЁАГСЗАЁБЕУЕНЦЋЗАЫсяЇЃЈNH4VO3ЃЉГСЕэЃЌаДГіЁАьбЩеЁБжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪН____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгвБэЮЊдЊЫижмЦкБэЕФвЛВПЗжЁЃ
ЬМ | ЕЊ | Y | |
X | Сђ | Z |
ЛиД№ЯТСаЮЪЬт
ЃЈ1ЃЉZдЊЫидкжмЦкБэжаЕФЮЛжУЮЊ__________ЁЃ
ЃЈ2ЃЉБэжадЊЫидзгАыОЖзюДѓЕФЪЧ(ЬюдЊЫиЗћКХ)__________ЁЃ
ЃЈ3ЃЉЯТСаЪТЪЕФмЫЕУїYдЊЫиЕФЗЧН№ЪєадБШSдЊЫиЕФЗЧН№ЪєадЧПЕФЪЧ__________ЃЛ
AЃЎYЕЅжЪгыH2SШмвКЗДгІЃЌШмвКБфЛызЧ
BЃЎдкбѕЛЏЛЙдЗДгІжаЃЌ1molYЕЅжЪБШ1molSЕУЕчзгЖр
CЃЎYКЭSСНдЊЫиЕФМђЕЅЧтЛЏЮяЪмШШЗжНтЃЌЧАепЕФЗжНтЮТЖШИп
ЃЈ4ЃЉЬМгыУОаЮГЩЕФ1molЛЏКЯЮяQгыЫЎЗДгІЃЌЩњГЩ2molMg(OH)2КЭ1molЬўЃЌИУЬўЗжзгжаЬМЧтжЪСПБШЮЊ9:1ЃЌQгыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЁЃ
ЃЈ5ЃЉСЊАБЃЈгжГЦСЊыТЃЌN2H4ЃЌЮоЩЋвКЬхЃЉЪЧвЛжжгІгУЙуЗКЕФЛЏЙЄдСЯЃЌПЩгУзїЛ№М§ШМСЯЃЌСЊАБЗжзгЕФЕчзгЪНЮЊЂй_____________ЃЌЦфжаЕЊЕФЛЏКЯМлЮЊЂк___________ЃЌЪЕбщЪвПЩгУДЮТШЫсФЦШмвКгыАБЗДгІжЦБИСЊАБЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊЂл ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПЕЊЕФЙЬЖЈОпгаживЊвтвхЁЃ
ЃЈ1ЃЉРзгъЬьЦјжаЗЂЩњздШЛЙЬЕЊКѓЃЌЕЊдЊЫизЊЛЏЮЊ ЖјДцдкгкЭСШРжаЃЎДІгкбаОПНзЖЮЕФЛЏбЇЙЬЕЊаТЗНЗЈЪЧN2дкДпЛЏМСБэУцгыЫЎЗЂЩњШчЯТЗДгІЃК
2N2ЃЈgЃЉ+6H2OЃЈlЃЉ=4NH3ЃЈgЃЉ+3O2ЃЈgЃЉЁїH K Ђй
вбжЊЃКN2ЃЈgЃЉ+3H2ЃЈgЃЉ=2NH3ЃЈgЃЉЁїH1=Љ92.4kJmolЉ1 K1 Ђк
2H2ЃЈgЃЉ+O2ЃЈgЃЉ=2H2OЃЈlЃЉЁїH2=Љ571.6kJmolЉ1 K2 Ђл
дђЁїH= ЃЛK= ЃЈгУK1КЭ K2БэЪОЃЉЁЃ
ЃЈ2ЃЉдкЫФИіШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌЗжБ№ГфШы1mol N2ЁЂ3mol H2OЃЌдкДпЛЏМСЬѕМўЯТНјааЗДгІЂй3аЁЪБЃЌЪЕбщЪ§ОнМћЯТБэЃК
ађКХ | ЕквЛзщ | ЕкЖўзщ | ЕкШ§зщ | ЕкЫФзщ | ||||||||||
t/Ёц | 30 | 40 | 50 | 80 | ||||||||||
NH3ЩњГЩСП/ЃЈ10Љ6molЃЉ | 4.8 | 5.9 | 6.0 | 2.0 | ||||||||||
ЯТСаФмЫЕУїЗДгІЂйДяЕНЦНКтзДЬЌЕФЪЧ ЃЈЬюзжФИЃЉЁЃK]
aЃЎNH3КЭO2ЕФЮяжЪЕФСПжЎБШЮЊ4ЃК3
bЃЎЗДгІЛьКЯЮяжаИїзщЗнЕФжЪСПЗжЪ§ВЛБф
cЃЎЕЅЮЛЪБМфФкУПЯћКФ1molN2ЕФЭЌЪБЩњГЩ2molNH3
dЃЎШнЦїФкЦјЬхУмЖШВЛБф
ШєЕкШ§зщЗДгІ3hКѓвбДяЦНКтЃЌЕкШ§зщN2ЕФзЊЛЏТЪЮЊ ЃЛгыЧАШ§зщЯрБШЃЌЕкЫФзщЗДгІжаNH3ЩњГЩСПзюаЁЕФдвђПЩФмЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌAЁЂBЁЂCЁЂDЁЂEЁЂX ЪЧдЊЫижмЦкБэИјГідЊЫизщГЩЕФГЃМћЕЅжЪЛђЛЏКЯЮяЁЃвбжЊ AЁЂBЁЂCЁЂDЁЂEЁЂX ДцдкШчЭМЫљЪОзЊЛЏЙиЯЕЃЈВПЗжЩњГЩЮяКЭЗДгІЬѕМўТдШЅЃЉЁЃ

ЃЈ1ЃЉШє E ЮЊбѕЛЏЮяЃЌдђ A гыЫЎЗДгІЕФЗНГЬЪНЮЊ____ ___ЃЌИУЗДгІжабѕЛЏМСКЭЛЙдМСЮяжЪЕФСПжЎБШЮЊ__________ ЁЃ
ЂйЕБ X ЮЊМюадбЮШмвКЃЌC Зжзгжага 22 ИіЕчзгЪБЃЌD ЪЧ__________ЃЈаДЛЏбЇЪНЃЉЁЃ
ЂкЕБ X ЮЊН№ЪєЕЅжЪЪБЃЌX гызуСП B ЕФЯЁШмвКЗДгІЩњГЩ C ЕФРызгЗНГЬЪНЮЊ________ __ЃЌаДГіМьбщЩњГЩЮя C ЕФбєРызгЫљгУЪдМСЕФЕчзгЪН__________ЁЃ
ЃЈ2ЃЉШє E ЮЊЕЅжЪЦјЬхЃЌD ЮЊАзЩЋГСЕэЃЌA ПЩФмЪЧ________ЃЈаДЛЏбЇЪНЃЉЃЌ XЪЧ_______ЃЈаДЛЏбЇЪНЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУДјОВЕчЕФгаЛњВЃСЇАєППНќЯТСавКЬхЕФЯИСїЃЌЯИСїЗЂЩњЦЋзЊЕФЪЧЃЈ ЃЉ
A. БН B. ЖўСђЛЏЬМ C. ТШЫЎ D. ЫФТШЛЏЬМ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗДгІaAЃЈgЃЉ+bBЃЈgЃЉ![]() cCЃЈgЃЉ(ЁїHЃМ0)дкЕШШнЬѕМўЯТНјааЁЃИФБфЦфЫћЗДгІЬѕМўЃЌдкЂёЁЂЂђЁЂЂѓНзЖЮЬхЯЕжаИїЮяжЪХЈЖШЫцЪБМфБфЛЏЕФЧњЯпШчЯТЭМЫљЪОЃК
cCЃЈgЃЉ(ЁїHЃМ0)дкЕШШнЬѕМўЯТНјааЁЃИФБфЦфЫћЗДгІЬѕМўЃЌдкЂёЁЂЂђЁЂЂѓНзЖЮЬхЯЕжаИїЮяжЪХЈЖШЫцЪБМфБфЛЏЕФЧњЯпШчЯТЭМЫљЪОЃК
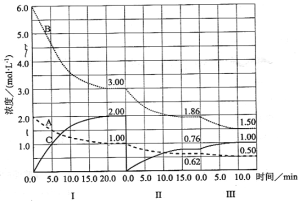
ЛиД№ЮЪЬтЃК
ЃЈ1ЃЉЗДгІЕФЛЏбЇЗНГЬЪНжаaЁУbЁУcЮЊ ЃЛ
ЃЈ2ЃЉгЩЕквЛДЮЦНКтЕНЕкЖўДЮЦНКтЃЌЦНКтвЦЖЏЕФЗНЯђЪЧ_____ЃЌВЩШЁЕФДыЪЉЪЧ____________ЁЃ
ЃЈ3ЃЉБШНЯЕкЂђНзЖЮЗДгІЮТЖШЃЈTЃВЃЉКЭЕкЂѓНзЖЮЗДгІЮТЖШЃЈTЃГЃЉЕФИпЕЭЃЛTЃВ TЃГЃЈЬюЁАЃМЁБЁАЃОЁБЁАЃНЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕтМАЦфЛЏКЯЮядкЩњВњЁЂЩњЛюКЭПЦММЕШЗНУцЖМгазХживЊЕФгІгУЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЕтВЛвЫШмгкЫЎЃЌЕЋвзШмгкЕтЛЏМиШмвКВЂЩњГЩЖрЕтРызгЃЌЗДгІШчЯТЃК
ЂйI2(s)+I-(aq)![]() I3-(aq) ЁїH<0ЃЛЂкI2(s)+2I-(aq)
I3-(aq) ЁїH<0ЃЛЂкI2(s)+2I-(aq)![]() I42-(aq)ЁЃЗДгІЂкЕФЦНКтГЃЪ§ЕФБэДяЪНЮЊK=___________ЁЃЮТЖШЩ§ИпЪБЃЌЗДгІЂйЕФЦНКтГЃЪ§НЋ____________(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)
I42-(aq)ЁЃЗДгІЂкЕФЦНКтГЃЪ§ЕФБэДяЪНЮЊK=___________ЁЃЮТЖШЩ§ИпЪБЃЌЗДгІЂйЕФЦНКтГЃЪ§НЋ____________(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)
ЃЈ2ЃЉЕтгыЮйдквЛЖЈЮТЖШЯТЃЌПЩЗЂЩњШчЯТПЩФцЗДгІЃКW(s)+I2(g)![]() WI2(g)ЁЃЯжзМШЗГЦШЁ0.508gЕтКЭ0.736gН№ЪєЮйЗХжУгк50.0mLЕФУмБеШнЦїжаЃЌВЂМгШШЪЙЦфЗДгІЁЃШчЭМЪЧЛьКЯЦјЬхжаЕФWI2еєЦјЕФЮяжЪЕФСПЫцЪБМфБфЛЏЙиЯЕЕФЭМЯѓ[n(WI2)ЁЋt]ЃЌЦфжаЧњЯпЂё(0ЁЋt2ЪБМфЖЮ)ЕФЗДгІЮТЖШЮЊ450ЁцЃЌЧњЯпЂђ(Дгt2ЪБПЬПЊЪМ)ЕФЗДгІЮТЖШЮЊ530ЁцЁЃ
WI2(g)ЁЃЯжзМШЗГЦШЁ0.508gЕтКЭ0.736gН№ЪєЮйЗХжУгк50.0mLЕФУмБеШнЦїжаЃЌВЂМгШШЪЙЦфЗДгІЁЃШчЭМЪЧЛьКЯЦјЬхжаЕФWI2еєЦјЕФЮяжЪЕФСПЫцЪБМфБфЛЏЙиЯЕЕФЭМЯѓ[n(WI2)ЁЋt]ЃЌЦфжаЧњЯпЂё(0ЁЋt2ЪБМфЖЮ)ЕФЗДгІЮТЖШЮЊ450ЁцЃЌЧњЯпЂђ(Дгt2ЪБПЬПЊЪМ)ЕФЗДгІЮТЖШЮЊ530ЁцЁЃ
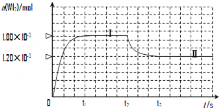
ЂйИУЗДгІЁїH__________0(ЬюЁА>ЁБЛђЁА<ЁБ)ЁЃ
ЂкЗДгІДгПЊЪМЕНt1(t1= 3 min)ЪБМфФкЕФЦНОљЫйТЪv(I2)= ЁЃ
Ђлдк450ЁцЪБЃЌИУЗДгІЕФЦНКтГЃЪ§K=______________ЁЃ
ЂмФмЙЛЫЕУїЩЯЪіЗДгІвбОДяЕНЦНКтзДЬЌЕФга (ЬюбЁЯюзжФИ)ЁЃ
AЃЎI2гыWI2ЕФХЈЖШЯрЕШ
BЃЎЕЅЮЛЪБМфФкЃЌН№ЪєЮйЯћКФЕФЮяжЪЕФСПгыЕЅжЪЕтЩњГЩЕФЮяжЪЕФСПЯрЕШ
CЃЎШнЦїФкЛьКЯЦјЬхЕФУмЖШВЛдйИФБф
DЃЎШнЦїФкЦјЬхбЙЧПВЛЗЂЩњБфЛЏ
ЃЈ3ЃЉI2O5ЪЧАзЩЋЗлФЉзДЙЬЬхЃЌПЩгУзїбѕЛЏМСЪЙH2SЁЂCOЁЂHC1ЕШбѕЛЏЃЌдкКЯГЩАБЙЄвЕжаГЃгУI2O5РДЖЈСПВтСПCOЕФКЌСПЁЃвбжЊЃКЂй2I2(s)+5O2(g)ЃН2I2O5(s) ІЄHЃН-75.56kJmol-1Ђк2CO(g)+O2(g)ЃН2CO2(g) ІЄHЃН-566.0kJmol-1 ЁЃаДГіCOЃЈgЃЉгыI2O5ЃЈsЃЉЗДгІЮіГіЙЬЬЌI2ЕФШШЛЏбЇЗНГЬЪНЃК__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтЛЏбЧЭ(CuH)ЪЧвЛжжФбШмЮяжЪЃЌгУCuSO4ШмвККЭЁАСэвЛЮяжЪЁБдк40~50ЁцЪБЗДгІПЩЩњГЩЫќЁЃCuHВЛЮШЖЈЃЌвзЗжНтЃЛдкТШЦјжаФмШМЩеЃЛгыЯЁбЮЫсЗДгІФмЩњГЩЦјЬхЃЛCu+дкЫсадЬѕМўЯТЗЂЩњЗДгІЪЧ2Cu+===Cu2++Cu ЁЃ
ИљОнвдЩЯаХЯЂЃЌНсКЯздМКЫљеЦЮеЕФЛЏбЇжЊЪЖЃЌЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдкCuSO4ШмвККЭЁАСэвЛЮяжЪЁБжЦCuHЕФЗДгІжаЃЌгУбѕЛЏЛЙдЙлЕуЗжЮіЃЌетЁАСэвЛЮяжЪЁБдкЗДгІжаЫљЦ№ЕФзїгУЪЧ (ЬюЁАбѕЛЏМСЁБЛђЁАЛЙдМСЁБ)ЁЃ
ЃЈ2ЃЉаДГіCuHдкТШЦјжаШМЩеЕФЛЏбЇЗДгІЗНГЬЪН ЁЃ
ЃЈ3ЃЉCuHШмвКдкЯЁбЮЫсжаЩњГЩЕФЦјЬхЪЧ (ЬюЛЏбЇЪН)ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com