
【题目】现有下列四种物质: A、次氯酸钙 B、碘酸钾 C、氨气 D、葡萄糖
请你根据题意,选择恰当的选项用字母代号填空
(1)能使湿润的红色石蕊试纸变蓝的是;
(2)漂白粉的有效成分是;
(3)加碘食盐中含有;
(4)人体内重要的供能物质是 .
科目:高中化学 来源: 题型:
【题目】对于反应A2+3B2![]() 2AB3 以下表示的反应速率中,速率最大的是( )
2AB3 以下表示的反应速率中,速率最大的是( )
A. V(A2)=0.4 molL-1min-1 B. V(B2)=0.8 molL-1min-1
C. V(AB3)=0.6 molL-1min-1 D. V(A2)=0.01 molL-1S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,溶液的pH随溶液体积变化的曲线如图所示,则下列叙述正确的是
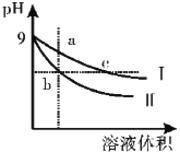
A. b、c两点溶液的导电能力b>c
B. 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb>Vc
C. c点溶液中c( H十)=c ( OH一)+c(CH3COOH)
D. a、b、c三点溶液中水的电离程度a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁和硫酸铝溶液等体积混合后,铝离子浓度为0.1mol·L-1,硫酸根离子的浓度为0.3mol·L-1,则混合液中镁离子的浓度为
A. 0.15mol·L-1 B. 0.3mol·L-1 C. 0.45mol·L-1 D. 0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列9种元素,完成以下各小题
周期 | IA | ⅡA | ⅢA | ⅣA | ⅥA | ⅦA | O | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)单质为有色气体的元素是(填名称).
(2)用电子式表示元素④和⑨形成化合物的过程 .
(3)最高价氧化物对应的水化物中酸性最强的是(填化学式).
(4)④和⑥的最高价氧化物对应的水化物反应的离子方程式为 .
(5)⑦的单质的用途正确的是 .
A.光导纤维
B.太阳能电池
C.普通玻璃
D.计算机芯片
(6)元素①和⑦非金属性较强的是(填写元素符号),写出一个能表示二者非金属性强弱关系的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧时焰色反应为黄色,则下列判断正确的是( )
A. 该物质一定是钠的化合物
B. 该物质一定是金属钠
C. 该物质一定是氯化钠
D. 该物质一定含钠元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的__区;溴的价电子排布式为__.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是__.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是__.
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:

请比较二者酸性强弱:HIO3__ H5IO6(填“>”、“<”或“=”).
(5)已知ClO2﹣为角型,中心氯原子周围有四对价层电子.写出一个ClO2﹣的等电子体__.
(6)图3为碘晶体晶胞结构.有关说法中正确的是__.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式中,正确的是( )
A.烧碱加入醋酸溶液OH﹣+CH3COOH═CH3COO﹣+H2O
B.盐酸与小苏打溶液反应2H++CO ![]() ═CO2↑+H2O
═CO2↑+H2O
C.氢氧化钡溶液中加入稀硫酸:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
D.金属钠与水反应Na+2H2O═Na++2OH﹣+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com