
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
C
解析试题分析:由于Al(OH)3的Ksp或溶解度远大于Fe(OH)3,所以向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液后先产生溶解度小的Fe(OH)3沉淀,随着氢氧化钠溶液的加入,逐渐产生氢氧化铝沉淀,由于氢氧化铝沉淀能溶于氢氧化钠溶液中,所以沉淀随着氢氧化钠的加入又逐渐减小。故C图正确。
考点:溶解度,Fe(NO3)3和Al(NO3)3 与NaOH溶液的化学反应
点评:本题难度中等,掌握随着氢氧化钠溶液的加入,逐渐产生氢氧化铝沉淀,由于氢氧化铝沉淀能溶于氢氧化钠溶液中,所以沉淀随着氢氧化钠的加入又逐渐减小是解题的关键,注意读懂题意是要表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,不是溶液中产生沉淀与NaOH溶液的体积的关系。


科目:高中化学 来源:2013届安徽省望江二中高三(复读班)第三次月考化学试卷(带解析) 题型:单选题
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是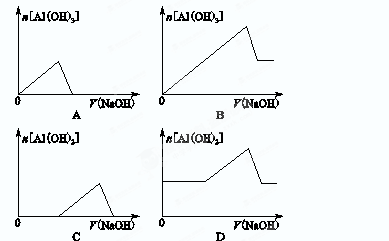
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省宜春市高三上学期第四次月考化学试卷(解析版) 题型:选择题
已知室温下,Al(OH)3的Ksp远大于Fe(OH)3。向浓度均为0.1mol/L的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积关系,合理的是( )
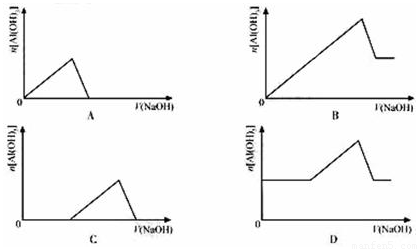
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏南四校高三12月月考试化学试卷(解析版) 题型:填空题
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(一)化学试卷(B卷)(解析版) 题型:选择题
[2012·安徽卷] 已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com