
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(1)除去油污(2分)
(2)4.4<a<7.5 (2分)
(3) 1.3×10-6 mol/L (2分)
(4)2mol(2分) 4Fe2++4H++O2=4Fe3++2H2O (2分)
(5)2Fe(OH)2++2H2O Fe2(OH)42++2H+ (2分)
Fe2(OH)42++2H+ (2分)
【解析】
试题分析:(1)纯碱溶液清洗可以除去铁屑表面的油污,有利于铁与硫酸反应。(2)溶液中含有Fe2+、Fe3+和Al3+,该过程需要将Fe3+和Al3+沉淀,但是不能沉淀Fe2+,故应调节溶液的pH的范围至4.4~7.5 。(3)Al(OH)3的Ksp=c(Al3+)×c(OH-)3=1.3×10-33,而当pH=5时,c(OH-)=1×10-9mol/L ,故c(Al3+)=1.3×10-6
mol/L 。(4)节约NaNO2的物质的量为2mol,可根据两个反应的方程式计算。O2参与反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O。(5)水解反应离子式为2Fe(OH)2++2H2O Fe2(OH)42++2H+ 。
Fe2(OH)42++2H+ 。
考点:制备实验的基本操作,简单的化学计算,离子反应式书写
点评:本题属于化工生产题目,结合铁变价金属的特殊性,进行解题,同时将PH与溶解平衡想联系,关键点在于氢氧根离子的浓度,每个小题都是不同的知识点,可以逐一击破。


科目:高中化学 来源: 题型:阅读理解

| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量 0.5mol.L-1BaCl2 0.5mol.L-1BaCl2 . |
产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) . |
若溶液紫色(或橙色)褪去,证明气体产物中含有SO2, 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2, 若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
硫酸亚铁是比较重要的亚铁盐,在农业上用作农药,主治小麦黑穗病,在工业上用于染色、制造蓝黑墨水和木材防腐、除草剂等.
(1)实验室条件下用铁粉和稀硫酸制取少量硫酸亚铁溶液,为防止其变质,应在该溶液中应加入适量______.
(2)新制的绿矾晶体(FeSO4?7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:______.
(3)已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8°C,沸点是44.8°C.
①装置II的试管中不装任何试剂,其作用是______,试管浸泡在50℃的热水浴中,目的是______.
②装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol.L-1.H2S04、6mol.L-1 NaOH、0.5mol.L -1 BaCl2、O.5mol.L-1Ba(NO3)2、0.01mol.L-1 酸性 KMnO4 溶液、0.0l mol.L-1 溴水.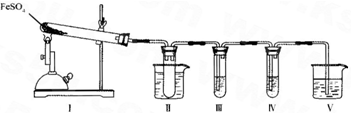
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
③装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是______.
④如何检验装置Ⅰ中固体完全分解后生成固体产物有无FeO?写出步骤、现象及结论:______.
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
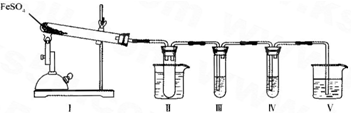
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
查看答案和解析>>
科目:高中化学 来源:2011年福建省泉州五中高考化学模拟试卷(解析版) 题型:解答题
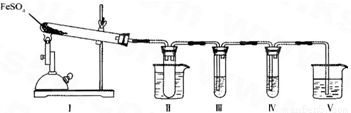
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com