
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
| 0.5 mol.L -1 BaCl2 | |
| 0.01 mol.L-1 酸性 KMnO4 溶液(或0.0l mol.L-1 溴水) | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |


科目:高中化学 来源: 题型:阅读理解

| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量 0.5mol.L-1BaCl2 0.5mol.L-1BaCl2 . |
产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) . |
若溶液紫色(或橙色)褪去,证明气体产物中含有SO2, 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2, 若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 . |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省福州市高三毕业班质检(第一次)理综化学试卷(解析版) 题型:填空题
(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈?????? 色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是????? 。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如图1:
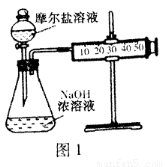
从上图推断甲同学想通过测定??????? 计算摩尔盐的纯度。该方案的不足之处在于??????????????? 。
(4)乙同学在甲同学的基础上做了改进,其实验装置如图2:
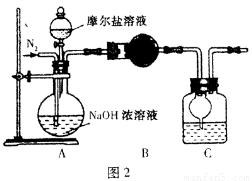
则B与C中的试剂分别是???????????? 和??????????????? 。C中干燥管的作用是???????????????????????? 。乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68 g,则依此数据推算这份摩尔盐的纯度为?????? %(答案精确到小数点后第一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
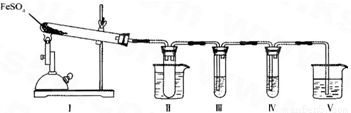
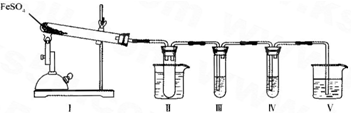
硫酸亚铁是比较重要的亚铁盐,在农业上用作农药,主治小麦黑穗病,在工业上用于染色、制造蓝黑墨水和木材防腐、除草剂等.
(1)实验室条件下用铁粉和稀硫酸制取少量硫酸亚铁溶液,为防止其变质,应在该溶液中应加入适量______.
(2)新制的绿矾晶体(FeSO4?7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:______.
(3)已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8°C,沸点是44.8°C.
①装置II的试管中不装任何试剂,其作用是______,试管浸泡在50℃的热水浴中,目的是______.
②装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol.L-1.H2S04、6mol.L-1 NaOH、0.5mol.L -1 BaCl2、O.5mol.L-1Ba(NO3)2、0.01mol.L-1 酸性 KMnO4 溶液、0.0l mol.L-1 溴水.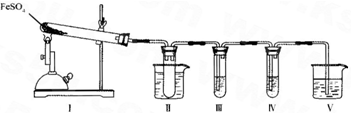
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
③装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是______.
④如何检验装置Ⅰ中固体完全分解后生成固体产物有无FeO?写出步骤、现象及结论:______.
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com