
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
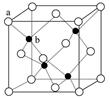
(1)三 ⅣA 大 (2) sp2 12 Cu 74% (3)小 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4)SiO2+2OH—= SiO32-+H2O SiO2 SiO2 为原子晶体,CO2为分子晶体
(5)2CO(g)+SO2(g)═S(s)+2CO2(g)△H=-270kJ/mol (6)ds 4.1
解析试题分析:根据题意可知X是C;Y是O;Z是Al;W是Si;T是S;P是Zn。(1)Si位于元素周期表第三周期第ⅣA。Si、C是同一主族的元素,由于从上到下原子核外电子层数增多,所以原子半径增大,因此Si的原子半径比C大;(2)(2)在SO2中的中心原子S的杂化方式为sp2杂化。CO2是分子晶体。在CO2中一个分子周围有12个CO2分子与其紧密相邻。堆积方式与CO2晶胞类型相同的金属有Cu。其空间利用率为74%。(3)Al的核外电子排布为1s22s22p63s1,当它失去第一个电子后变为全空的稳定状态。所以其第一电离能比Mg的小。Al单质与NaOH溶液反应的化学方程式为2Al+2NaOH+ 2H2O= 2NaAlO2+3H2↑。(4)SiO2是酸性氧化物,能与碱反应得到盐和水。其与NaOH溶液反应的离子方程式是SiO2+2OH—= SiO32-+H2O。SiO2 为原子晶体,原子间以共价键结合,共价键是一种强烈的相互作用,断裂需要消耗很多的能量;而CO2为分子晶体,分子间以分子间作用力结合。分子间作用力比化学键弱的多,所以二者比较熔沸点较高的是SiO2。①×2-②。整理可得2CO(g)+SO2(g)═S(s+2CO2(g)△H=-270kJ/mol。(6)30号元素Zn在周期表中位于第四周期第ⅡB族,属于ds区的元素。由ZnS的晶体结构示意图可知:在该晶体的一个晶胞中含有Zn:1/8×8+1/2×6=4;含有S:1×4=4.既一个晶胞中含有4个ZnS。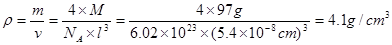 。
。
考点:考查元素的推断、元素周期表、元素周期律的应用、热化学方程式的书写及晶体结构的知识。


科目:高中化学 来源: 题型:填空题
CaC2可用于固氮:CaC2+N2  CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式 。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为 ,1molCS2中含有的π键为 个。
(3)Y的中心原子的杂化轨道类型为 ,分子的立体构型为 。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因 。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为 。
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为 ,该氮化钛的化学式为 ,氮原子的配位数为 。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为 g.cm3(NA为阿佛加德罗常数值,只列式计算)。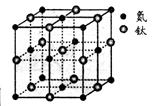
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,已知W的一种同位素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻,N的单质是日常生活中常用的金属材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最强。
(1)W的另一种同位素的质子数与中子数相等,原子符号表示为 ;元素Y在周期表中的位置是 。
(2)下列有关物质性质的比较中,正确的是 (填字母编号)。
| A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X |
| B.M、X、Z三种元素形成的单质熔点:X>M>Z |
| C.Y、Z两种元素的含氧酸酸性:Z>Y |
| D.Y、Z两种元素的单核阴离子还原性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。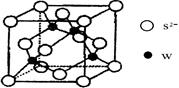
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是 ;
(2)C、D、E的第一电离能由大到小的顺序是:
(3)下列有关上述元素的说法中,不正确的是 (填字母)
a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含 个σ键。
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为 ;
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
碳、氮、氧、氟都是位于第二周期的重要的非金属元素。请回答下列问题:
(1)基态氟原子的核外电子排布式是______________ 。
(2)C、N、O、F四种元素第一电离能从大到小的顺序是_________________。
(3)碳和另外三种元素均可形成化合物。四氟化碳的空间构型为____________,CF4可以利用甲烷与Cl2和HF在一定条件下反应来制备,其反应方程式为___________;CO是__________分子(填“极性”或“非极性”),CO的常见等电子体为N2、CN-,已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________;C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具,可推测出C3N4属于_________晶体。
(4)N4分子结构和白磷一样都是正四面体。又已知断裂1molN-N键吸收167kJ热量,生成1 molN≡N键放出942kJ热量,0.1 molN4转变为N2将放出____________热量:
(5)CaF2和CaC2都属于离子晶体。CaF2晶体的密度为a g·cm-3,则晶胞(如图)的体积是_______________(只要求列出算式)。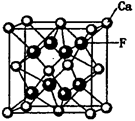
(6)CaC2晶体的晶胞与氯化钠相似,但由于CaC2晶体中的C 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C 周围距离最近且相等的Ca2+数目为__________,C
周围距离最近且相等的Ca2+数目为__________,C 与O
与O 互为等电子体,O
互为等电子体,O 的电子式为____________。
的电子式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com