
CaC2可用于固氮:CaC2+N2  CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
(1)1s22s22p63s23p63d104s2或[Ar]3d104s2(2)C O N(3)sp3 平面正三角形
(4)CO2或N2O CaCN2 +3H2O=CaCO3+2NH3↑
解析试题分析:(1)Ca位于第四周期、最外层电子数为2,最外层电子数为2、内层排满电子的第四周期元素原子是Zn,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2。(2)同周期元素从左向右,第一电离能总体趋势增大,但IIA和VA反常,第一电离能:N>O>C。(3)NH3中N形成3个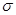 键,还有1对孤对电子,N杂化类型为sp3。CO32-中C价层电子对数=
键,还有1对孤对电子,N杂化类型为sp3。CO32-中C价层电子对数=  ,C与3个O成键,空间构型为平面三角形。(4)等电子体原子数相同、价电子数相同。C2-与O原子数相等,所以与CN22-互为等电子体的分子有N2O,N2与CO互为等电子体,与N2O互为等电子体的分子有CO2、BeCl2等。CaCN2与水生成NH3,同时生成CaCO3。
,C与3个O成键,空间构型为平面三角形。(4)等电子体原子数相同、价电子数相同。C2-与O原子数相等,所以与CN22-互为等电子体的分子有N2O,N2与CO互为等电子体,与N2O互为等电子体的分子有CO2、BeCl2等。CaCN2与水生成NH3,同时生成CaCO3。
考点: 核外电子排布式 第一电离能 中心原子杂化类型 离子空间构型 等电子体 化学方程式的书写


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| | W | X | Y | Z |
| 结构或性质 | 最高价氧化物是温室气体,其原子的最外层电子数是次外层电子数的2倍 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 氧化物是常见的两性化合物 | 最高正价与最低负价之和为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国高校目前联合研究一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为______
(2)S与O为同主族元素,其中电负性较大的是____________;H2S分子中S原子杂化轨道类型为______;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:_______。
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应生成NH2-NH2,NH2—NH2能否作配体?______(填“能”或“否”)
②CaO形成的晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含 有Ca2+数为______ ;欲比较CaO与NaCl的晶格能大小,需考虑的数据是______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。
(1)Y在周期表中的位置是 。
(2)用电子式解释X与W能形成化合物X3W的原因 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是 。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是 。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g)  2A(g) △H =-92.4 kJ?mol―1
2A(g) △H =-92.4 kJ?mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有五种短周期主族元素A、B、C、 D、E,其原子序数依次增大。A原子约占宇宙中原子总数的88.6%,A+又称为质子:B是形成化合物种类最多的元素,C元素的最简单的氢化物Y的水溶液显碱性.E是短周期元素中电负性最小的元素。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式____。
(2)向氯化亚铁溶液滴加过量的E的最高价氧化物对应水化物的溶液,现象是____。
(3)Y溶液显碱性的原因是(用一个离子方程式表示)____。
(4)检验汽车尾气中含有的化合物BD的方法是:向酸性PdC12溶液中通A汽车尾气,若生成黑色沉淀(Pd),证明汽车尾气中含有BD。写出反应的离子方程式____。
(5)下列有关物质性质的比较中.不正确的是 。
a.热稳定性:H2S>SiH4 b.离子半径:Na+>S2-
c.第一电离能N>O d.元素电负性:C>H
(6)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知.CH3OH的燃烧热____(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol.则表示氢气燃烧热的热化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、Y、Z为四种短周期主族元素,其位置关系如图。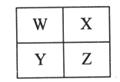
(1)若X原子的最外层电子数是次外层的3倍。
①元素X在周期表中的位置___________________________________。
②工业上由W的单质制备W的气态氢化物的化学方程式是
_______________________________________________________________________。
(2)若四种元素中只有一种金属元素。
①冶炼Y的化学方程式是__________________________________________。
②工业上,将X的单质与Z的最高价氧化物加热到1900℃以上可制得一种新型陶瓷(ZX),同时得到一种可燃性气体,该反应的化学方程式是
_________________________________
③为比较X、Z最高价氧化物的水化物酸性强弱,某同学设计如下实验。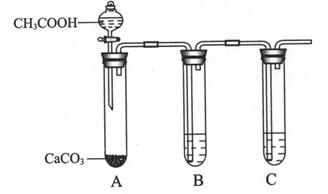
I. B试管中盛放的试剂是______________________。
II. C试管中反应的化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为 ;
(2)乙元素在周期表中的位置为 ;
(3)丙元素的最高价氧化物的电子式为 ;
(4)甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com