
【题目】室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是

A. Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B. V(NaOH)=10.00 mL 时 >1
>1
C. pH=7时,两种酸所用NaOH溶液的体积相等
D. V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-)
【答案】B
【解析】
A、滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误;
B、加入10mL氢氧化钠时,溶液中恰好为同浓度的醋酸和醋酸钠,醋酸电离大于醋酸根的水解程度,故 >1,故B正确;
>1,故B正确;
C、醋酸钠水解呈碱性,氯化钠不水解,pH=7时,醋酸所用NaOH溶液的体积小,故C错误;
D、V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠,醋酸根发生水解,浓度小于氯离子,故D错误.
答案选B。
【点晴】
本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用醋酸电离大于醋酸根的水解程度做题。要学会根据滴定曲线和指示剂的发色范围选用指示剂:①0.1mol/L NaOH 滴定盐酸,酚酞和甲基橙均可使用,当然两者测定结果不同;②0.1mol/L NaOH溶液滴定0.1mol/L CH3COOH溶液,恰好中和生成CH3COONa,溶液呈弱碱性,选酚酞为指示剂,pH=8~10浅红色,误差小;③用HCl滴定NH3·H2O恰好中和生成NH4Cl,溶液呈弱酸性,选甲基橙为指示剂,3.1~4.4橙色,误差小;④用HCl滴定0.1mol/L Na2CO3溶液,第一步生成NaHCO3时,可选用酚酞为指示剂,由红色→浅红→无色,化学方程式为:Na2CO3+HCl═NaHCO3+NaOH;第二步生成碳酸(CO2↑+H2O),可选用甲基橙为指示剂,由黄色→橙色,化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(![]() )悬浊液静置,取上层清液,再通入
)悬浊液静置,取上层清液,再通入![]() ,溶液中尿酸的浓度
,溶液中尿酸的浓度![]() 与
与![]() 的关系如图所示。己知:
的关系如图所示。己知:![]() ,
,![]() ,下列说法正确的是
,下列说法正确的是
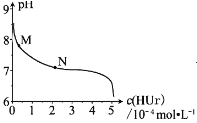
A. 上层清液中,![]()
B. 当![]() 时,
时,![]()
C. 在![]() 的变化过程中,c(Na+) ·c(Ur-)的值将逐渐减小
的变化过程中,c(Na+) ·c(Ur-)的值将逐渐减小
D. 当![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Ba(OH)2·8H2O固体与NH4Cl固体反应的化学方程式为_____________。
(2)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。理论上,每生成1 mol NH3___________热量(填“吸收”或“放出”)__________kJ;事实上,反应的热量总小于理论值,为什么?________________。
(3)一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)
5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)

(4)已知N2(g)+ 3H2(g) ![]() 2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
(5)已知一定条件下发生:2SO2(g) + O2(g) ![]() 2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)

t1________________________;t2________________________;
t3________________________;t4________________________。
(6)①某电池采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中_______作正极,负极的电极反应为_________________。
②甲烷燃料电池示意图如上图乙,其负极反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |
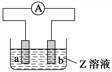
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
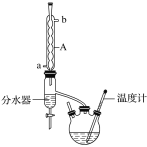
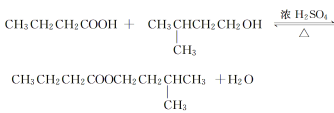
【题目】丁酸异戊酯又称香蕉油,多用于食品和化妆品的香精,实验室用正丁酸与异戊醇反应制备丁酸异戊酯,有关数据和装置示意图如下:
相对分子质量 | 密度(g·cm-3) | 沸点(℃) | 水中溶解性 | |
正丁酸 | 88 | 0.958 7 | 163.5 | 溶 |
异戊醇 | 88 | 0.813 2 | 131 | 微溶 |
丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |
实验步骤:
①如图连接好装置,在三颈烧瓶中加入0.2 mol异戊醇、0.1 mol正丁酸、数滴浓硫酸、5 mL苯和2~3片碎瓷片。充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122~132℃下回流反应1.5h即可得粗产品;
③冷却后用10%的NaOH溶液中和用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酯11g。
回答下列问题:
(1)图中A仪器的名称是___________。
(2)在该实验中,三颈烧瓶的容积最适合的是_____(填字母)。
A.50mL B.100mL C.200mL
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____(填字母)。
A.冷却后补加 B.立即补加 C.不需补加 D.重新配料
(4)分离提纯过程中加入无水硫酸镁的目的是______________。
(5)在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是_______(填字母)。

(6)本实验的产率是______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶( )广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
)广泛应用于汽车部件、建筑用防水材料、电线电缆护套、耐热胶管、汽车密封件、润滑油添加剂及其它制品。
PC塑料(  )的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:
)的透光性良好,可制作车、船、飞机的挡风玻璃以及眼镜等。它们的合成路线如下:
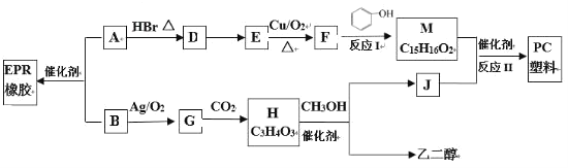
已知:①RCOOR1+R2OH→ RCOOR2 +R1OH
②B、F、G、H、J各物质中,核磁共振氢谱都只有一组吸收峰。
(1)B的结构简式:____________。
(2)A→D的反应类型:____________。
(3)E中官能团名称:____________。
(4)E→F的化学方程式:____________。
(5)H的结构简式:____________。
(6)反应II的化学方程式:____________。
(7)下列说法正确的是:____________。
a.反应I的原子利用率为100%
b.1mol J与足量的NaOH溶液反应,消耗2molNaOH
c.CH3OH在合成PC塑料过程中可以循环利用
(8)反应I过程中,可以得到两种同类型副产物,且与M互为同分异构体,请写出其中一种结构:_________。
(9)![]() ,试推断N的结构:____________。
,试推断N的结构:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
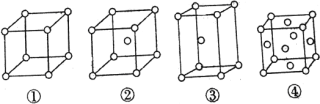
A. ①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为①1个②2个③4个④4个
C. 晶胞中原子的配位数分别为①6 ②8 ③12 ④12
D. 空间利用率的大小关系为①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更简便制取干燥NH3,下列方法中适合的是( )
A.NH4Cl与H2SO4(浓)混合加热,生成的气体用碱石灰进行干燥
B.N2+3H2![]() 2NH3,用烧碱干燥
2NH3,用烧碱干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4Cl用P2O5干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com