

分析 海水中加入氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤后在沉淀中加入盐酸溶解,得到氯化镁溶液,通过浓缩蒸发,冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到无水氯化镁,电解熔融氯化镁得到金属镁;
(1)利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂,需要加入过量氢氧化钠溶液沉淀;
(2)分离固体和液体用过滤,利用溶解性的差异来分析;
(3)根据框图从氢氧化镁到氯化镁的反应分析,需要加入盐酸溶解;
(4)根据题目中提供的反应物和生成物解答,电解熔融氯化镁得到镁和氯气.
解答 解:(1)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择NaOH,反应的离子方程式为Mg2++2OH-=Mg(OH)2↓,
故答案为:NaOH;Mg2++2OH-=Mg(OH)2↓;
(2)过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,所以分离得到Mg(OH)2沉淀的方法是过滤,故答案为:过滤;
(3)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:盐酸;Mg(OH)2+2H+=Mg2++2H2O;
(4)氯化镁电解为分解反应,产物为镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 能发生酯化反应的酸一定是羧酸 | |
| B. | 油脂的水解反应又叫皂化反应 | |
| C. | 天然蛋白质水解的最后产物是多种α-氨基酸 | |
| D. | 淀粉、纤维素、油脂都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以从海水中提取出铀和重水等核能开发中的重要原料 | |
| B. | 利用潮汐发电是将化学能转化为电能 | |
| C. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| D. | 海水中含有钾元素,只需通过物理变化就可以得到钾单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )| A. | ①是CCl4,②是苯,③是酒精 | B. | ①是酒精,②是CCl4,③是苯 | ||
| C. | ①是苯,②是CCl4,③是酒精 | D. | ①是苯,②是酒精,③是CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的裂化、油脂的硬化、煤的液化均属于化学变化 | |
| B. | 葡萄糖、蔗糖、麦芽糖均属于还原性糖 | |
| C. | 淀粉、纤维素均属于天然高分子化合物 | |
| D. | Al2O3、Al(OH)3、氨基酸均为两性化合物,能与酸、碱反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 及时将乙酸乙酯蒸出,平衡向生成乙酸乙酯的方向移动 | |
| B. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| C. | 试管b中导气管下端不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| D. | 反应结束后用分液的方法分离试管b中的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
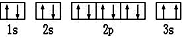 ,违背了泡利不相容泡利原理.
,违背了泡利不相容泡利原理.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图中反应②的提示:C2H5OH+HO-NO2$→_{△}^{浓硫酸}$C2H5O-NO2+H2O
图中反应②的提示:C2H5OH+HO-NO2$→_{△}^{浓硫酸}$C2H5O-NO2+H2O (烃基可用R1、R2、R3表示).
(烃基可用R1、R2、R3表示). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(g)△H=-48.40KJ/mol | |
| B. | C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(l)△H=-5518KJ/mol | |
| C. | C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(l)△H=+5518KJ/mol | |
| D. | C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(l)△H=-48.40KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com