

| A. | 及时将乙酸乙酯蒸出,平衡向生成乙酸乙酯的方向移动 | |
| B. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| C. | 试管b中导气管下端不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| D. | 反应结束后用分液的方法分离试管b中的混合液 |
分析 A.反应为可逆反应,根据平衡移动原理分析;
B.浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
C.挥发出的乙酸、乙醇易溶于水;
D.乙酸乙酯不溶于饱和碳酸钠溶液,混合液分层,可通过分液操作分离出乙酸乙酯.
解答 解:A.酯化反应为可逆反应,及时将乙酸乙酯蒸出,使反应向生成乙酸乙酯的方向移动,故A正确;
B.浓硫酸密度较大,且混合时放热,所以配制混合液时先加入一定量的乙醇,然后边振荡边加入浓硫酸,冷却后再加入冰醋酸,顺序不能颠倒,故B错误;
C.挥发出的乙酸、乙醇易溶于水,试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象,故C正确;
D.乙酸乙酯不溶于饱和碳酸钠溶液,所以混合液分层,通过分液操作可分离出乙酸乙酯,故D正确;
故选B.
点评 本题考查乙酸乙酯的制备方法,题目难度不大,注意制取乙酸乙酯加入试剂时应考虑浓硫酸的稀释问题,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | 水结成冰体积膨胀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纤维素和硫酸加热水解后的液体取出少许,加入新制的Cu(OH)2悬浊液,并加热,若有红色沉淀生成,证明纤维素水解生成了葡萄糖 | |
| B. | 蛋白质溶液中加入甲醛可以使蛋白质从溶液中析出,加水又溶解 | |
| C. | 蔗糖和麦芽糖互为同分异物体,它们均能发生银镜反应 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸(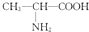 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 | |
| D. | 向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、汽油、植物油和聚乙烯塑料都是碳氢化合物 | |
| B. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| C. | 水电站把机械能转化成电能,而核电站是把化学能转化成电能 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
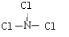 ;由A、B、D三种元素组成的18电子微粒的电子式为
;由A、B、D三种元素组成的18电子微粒的电子式为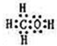
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
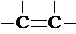 )的链状化合物C300H298,则含-C≡C-的个数为( )
)的链状化合物C300H298,则含-C≡C-的个数为( )| A. | 70 | B. | 72 | C. | 74 | D. | 76 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com