
下列图示与对应的叙述相符的是

A.由图甲可以判断:对于反应aA(g)+ bB(g) cC(g),若T1>T2, 则a +b=c且 △H<0
cC(g),若T1>T2, 则a +b=c且 △H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L醋酸溶液得到的滴定曲线
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:

(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于____________(填“离子化合物”或“共价化合物”)。
②反应I的化学方程式为____________________________________________。
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为________________mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34g mol
mol ,则:
,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为_______(填化学式)。
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式_______________________。在该反应中若有74.5 g NaClO被还原,则转移电子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1
(2)C(s)+O2(g)=CO2(g) △H2
(3)2H2(g)+O2(g)=2H2O(l) △H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) △H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H5
下列关于上述反应的焓变的判断正确的是
A.△H1>0,△H2<0 B.△H5=2△H2+△H3-△H1
C.△H3>0,△H5<0 D.△H4=△H1-2△H3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
在铁和铜的混合物中加入一定量的稀硝酸,充分反应后剩余金属的质量为m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属的质量为m2g,则m1与m2的关系是
A.m1>m2 B.m1≤m2 C.m1≥m2 D.m1= m2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:

请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)图3为碘晶体晶胞结构。有关说法中正确的是____________。
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加徳罗常数的值,下列说法正确的是
A.常温常压下,2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA
B.30g乙酸和甲醛的混合物中氧原子数为NA
C.25℃时,2L0.1mol/L的Na2CO3溶液中含有的CO32-总数为0.2 NA
D.某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO3分子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:填空题
(10分)某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:
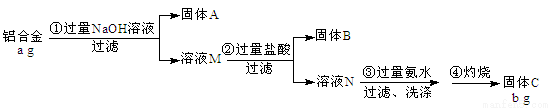
已知:Si+ 2NaOH + H2O = Na2SiO3 + 2H2↑,H2SiO3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(4)下列因操作不当,会使测定结果偏大的是___________
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第④步中的沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:填空题
(12分)皮革工业污泥中含较多的Cr,工业采用以下工艺制得M[Cr(OH)(H2O)5SO4]。

已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 9.3 | --- |
沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 11.1 | 9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________________(任写一条)。
(2)调节pH所用X可以选用 。
A.NaOH B.Na2CO3 C.H2SO4 D.HNO3
(3)加入H2O2 目的是把Cr(OH)3沉淀转化为Cr2O72-,写出该反应的离子方程式 。针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(4)调滤液至pH=8,Al3+、Cu2+、Mg2+中的_________将转化为沉淀。
(5)若滤液甲的pH=a,则溶液中c (Cu2+)= 。(25℃时的Ksp[ Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高二上学期期末考试化学(文)试卷(解析版) 题型:填空题
(6分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装上“催化转换器”(用钯、铂合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式_________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度。其原因是______________________________________________________。
(3)控制城市污染源的方法可以有___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com