
��12�֣���֪�����������ڡ���������Ķ����ڷǽ���Ԫ��X��Y��������������ˮ�����Ϊǿ�ᡣ������ͼת����ϵ(��Ӧ���������ֲ�������ȥ)���ش��������⣺

��1����A��B��C��D��Ϊ��XԪ�صĻ������A��F�ķ��Ӿ�Ϊ10����������
��F����____________(����ӻ�������ۻ����)��
�ڷ�ӦI�Ļ�ѧ����ʽΪ____________________________________________��
�۽�1.92gͭ����һ������D��Ũ��Һ��Ӧ����ͭ����ȫ��Ӧʱ�ռ�������1.12L(��״��)����Ӧ���ĵ�D�����ʵ���Ϊ________________mol��
��2����A��B��C��D��Ϊ��YԪ�صĻ��������A������Ԫ����ɣ���A��Ħ������Ϊ34g mol
mol ����
����
�ٽ�ͭ����D��Ũ��Һ��Ӧ������Һ�������ɣ��õ��İ�ɫ��������Ϊ_______(�ѧʽ)��
�ڽ�����Na2Y��Һ�μӵ�����������Һ�з�����Ӧ���������ɣ���д���÷�Ӧ�����ӷ�Ӧ����ʽ_______________________���ڸ÷�Ӧ������74.5 g NaClO����ԭ����ת�Ƶ��ӵ����ʵ���Ϊ_________mol��
��12�֣�ÿ��2�֣�
��1���ٹ��ۻ����� ��4NH3��5O2 4NO��6H2O ��0.11
4NO��6H2O ��0.11
��2����CuSO4 ��S2����4ClO��===SO42����4Cl�� ��2
��������
�����������Ԫ�����ڱ��У������������ڡ���������Ķ����ڷǽ���Ԫ��X��Y��������������ˮ�����Ϊǿ�ᣬ������ַǽ���Ԫ����N��SԪ�ء�����X��NԪ�أ�Y��SԪ�ء�
��1����A��B��C��D��Ϊ��XԪ�صĻ������A��F�ķ��Ӿ�Ϊ10����������A��NH3��������������Ӧ����NO����B��NO��NO��������Ӧ���ɶ�������������������ˮ��Ӧ�������ᣬH2OΪ10���ӷ��ӣ�Ϊ���ۻ�������Ԣ�F�ǹ��ۻ�����ڰ����������ڸ��¡������������·�Ӧ����NO��ˮ����ѧ����ʽ��4NH3��5O2 4NO��6H2O����1.92gCu�����ʵ�����0.03mol��Cu��Ũ���ᷴӦ����0.03mol������ͭ��δ����ԭ����������ʵ�����0.06mol��������������ʵ�����1.12L/22.4L/mol=0.05mol�����Բμӷ�Ӧ����������ʵ�����0.06+0.05=0.11mol��
4NO��6H2O����1.92gCu�����ʵ�����0.03mol��Cu��Ũ���ᷴӦ����0.03mol������ͭ��δ����ԭ����������ʵ�����0.06mol��������������ʵ�����1.12L/22.4L/mol=0.05mol�����Բμӷ�Ӧ����������ʵ�����0.06+0.05=0.11mol��
��2����A��B��C��D��Ϊ��SԪ�صĻ��������A������Ԫ����ɣ���A��Ħ������Ϊ34g mol
mol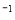 ����A��H2S��B�Ƕ�������C����������D�����ᡣ��Cu��Ũ������ȷ�Ӧ��������ͭ�Ͷ�������ˮ������Һ�������ɣ��õ��İ�ɫ��������Ϊ��ˮ����ͭ����ѧʽ��CuSO4��
����A��H2S��B�Ƕ�������C����������D�����ᡣ��Cu��Ũ������ȷ�Ӧ��������ͭ�Ͷ�������ˮ������Һ�������ɣ��õ��İ�ɫ��������Ϊ��ˮ����ͭ����ѧʽ��CuSO4��
�ڽ�����Na2S��Һ�μӵ�����������Һ�з�����Ӧ���������ɣ�˵�������������������ӷ���������ԭ��Ӧ������������Ӻ������ӣ����ӷ���ʽ��S2����4ClO��===SO42����4Cl�� ��74.5 g NaClO�����ʵ�����1mol��ClԪ�صĻ��ϼ۴�+1�۽��͵�-1�ۣ����Է�Ӧ��ת�Ƶ��ӵ����ʵ�����2mol��
���㣺����S��N�Ļ����������Ӧ�ã�������ԭ��Ӧ�ļ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ������Fe��FeO��Fe2O3��Fe3O4�Ļ�����м���350 mL 2 mol��L��1��ϡ����ǡ��ʹ�������ȫ�ܽ⣬�ų�2.24 L NO(��״��)����������Һ�м���KSCN��Һ����ɫ���֡�����������H2�ڼ��������»�ԭ��ͬ�����Ļ������õ����������ʵ���Ϊ
A��0.21 mol B��0.25 mol C��0.3 mol D��0.35 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������һ����У������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A�����ݷ�ӦCu��H2SO4 CuSO4��H2�����Ƴ�Cu�Ļ�ԭ�Ա�H2��ǿ
CuSO4��H2�����Ƴ�Cu�Ļ�ԭ�Ա�H2��ǿ
B����⺬Pb��NO3��2��Cu��NO3��2����Һ�������������ӵõ��Ӵ�˳������Cu2����H����Pb2+
C����amolNa2S����Һ���������2.5amol�Ķ�����������
D����Cl2��������ǿ��I2�������ԣ������û���ӦI2��2NaClO3===2NaIO3��Cl2���ܷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡΫ���и���12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������£�һ���ܴ����������������
A����ɫ����ˮ��Һ�У�K����Ba2����Cl����MnO4��
B�����д���NO3����ˮ��Һ�У�NH4����Fe2����SO42����H��
C�������̪�Լ��Ժ�ɫ����Һ�У�Na����K����CO32����Br��
D��ǿ������Һ�У�ClO����S2����HSO3����Na��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡΫ���и���12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ƶ���ȷ����
A����ɫ��ѧ�ĺ�����Ӧ�û�ѧԭ���Ի�����Ⱦ��������
B�����ǵؿ��к���λ�ӵڶ���Ԫ�أ���觡����ά����Ҫ�ɷ�ΪSiO2
C������240 mL 1 mol��L��1��NaOH��Һ���NaOH���������Ϊ9.6 g
D��Ҫ��ȥ�·��ϵ�������գ����ɽ��·�����Ư��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ������Ǧ��������Դ��ⱥ��ʳ��ˮ��ȡ��������֪Ǧ���طŵ�ʱ�������·�Ӧ��
������Pb��SO42-�� PbSO4��2e?
������PbO2��4H+��SO42-��2e? �� PbSO4��2H2O
�����Ƶ�Cl2 0.10 mol����ʱ��������ĵ�H2SO4�����ʵ���������
A��0.025 mol B��0.050 mol C��0.10 mol D��0.20 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������л�����ص�˵����ȷ����
A����������춡�黥Ϊͬ���칹�壬�����к�����ͬ��Ŀ��C-C����
B���ƾ���ʹ�����ʱ��ԣ�ҽ���ϳ�����ˮ�ƾ���������
C���ع��Ϳ���������ȼ�ϣ�����������͡�ú�͡�������ͬ
D�����ۺ���ά�ض��������࣬����ά�ز���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�����и�����ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л�������в�������ԭ�Ӷ���ͬһƽ�����
A���屽 B������ϩ C���ױ� D����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��ˮ�и�������μ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼʾ���Ӧ�������������

A����ͼ�����жϣ����ڷ�ӦaA(g)+ bB(g) cC(g)����T1>T2�� ��a +b=c�� ��H<0
cC(g)����T1>T2�� ��a +b=c�� ��H<0
B��ͼ�ұ�ʾѹǿ�Կ��淴Ӧ2A(g)+2 B(g) 3C(g)+D��s����Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
3C(g)+D��s����Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
C������ͼ��������ȥCuSO4��Һ�е�Fe3+��������Һ�м�������NaOH��Һ������pH��4
D��ͼ����ʾ��0.1000mol/LNaOH��Һ�ζ�20.00mL0.1000mol/L������Һ�õ��ĵζ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com