
| A. | 对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol,表明破坏旧化学键吸收的能量比形成新化学键释放的能量多 | |
| B. | 2MnO(s)+O2(g)═2MnO2(s),该反应在低温下能自发进行,则其△H<0 | |
| C. | 用干燥的pH试纸测得某氯水的pH=3.1 | |
| D. | 航行在大海中的轮船水面上的部分比水面下的部分腐蚀得慢,因为水下易发生电化学腐蚀 |
分析 A.焓变等于断键吸收的能量减去成键释放的能量;
B.△H-T△S<0的反应可自发进行;
C.氯水中含HClO,具有漂白性;
D.水面下的部分腐蚀,钢铁与海水构成原电池.
解答 解:A.H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol,为放热反应,则破坏旧化学键吸收的能量比形成新化学键释放的能量少,故A错误;
B.2MnO(s)+O2(g)═2MnO2(s)的△S<0,△H-T△S<0的反应可自发进行,该反应在低温下能自发进行,则其△H<0,故B正确;
C.氯水中含HClO,具有漂白性,不能利用试纸测定氯水的pH,应选pH计,故C错误;
D.水面下的部分腐蚀,钢铁与海水构成原电池,易发生电化学腐蚀,故D正确;
故选BD.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、反应进行方向、pH测定、电化学腐蚀为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
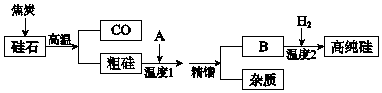
| 物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
| 熔点/℃ | -70 | -128.2 | 306 | -- |
| 沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应的△H>0,吸热反应的△H<0 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做电解池的阴极,和外加电源的负极相连 | |
| B. | 做电解池的阴极,和外加电源的正极相连 | |
| C. | 做电解池的阳极,和外加电源的负极相连 | |
| D. | 做电解池的阳极,和外加电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应③为放热反应 | |
| B. | 当容器内湿埋不再变化时,上述各反应均达到化学平衡状态 | |
| C. | 当混合气体的密度不再变化时,上述各反应均达到化学平衡状态 | |
| D. | 若反应①的平衡常数为K1,反应②的平衡常数为K2,则反应③的平衡常数K3=2K1•K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯萃取碘水中的I2,分出水层的操作为从上口倒出 | |
| B. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 配制245mL0.1 mol•L-1的NaOH溶液,需要245mL容量瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com