
���� ��1��Al3+��3HCO3-��������ˮ�ⷴӦ�����������������Ͷ�����̼���壻
��2����������ˮ�����ӷ���ˮ�ⷴӦ�����������������壬����������������������ʣ���ˮ���ã�
��3��������ǿ�������Σ�̼�������ˮ�����Һ�ʼ��ԣ����������´ٽ�����ˮ�⣻
��4������������笠����ӵ�ˮ�⣬ˮ���Լ��Ե����Ӵٽ�笠����ӵ�ˮ�⣮
��� �⣺��1��Al3+��3HCO3-��������ˮ�ⷴӦ����Ӧ�����ӷ���ʽΪ��Al3++3HCO3-�TAl��OH��3��+3CO2������������������̼���壬���������
�ʴ�Ϊ��Al3++3HCO3-�TAl��OH��3��+3CO2����
��2������[KAl��SO4��2•12H2O]��Ϊ��ˮ������Ϊ��������ˮ����ˮ�ⷴӦ�����������������壬����������������������ʣ���Ӧ�����ӷ���ʽΪAl3++3H2O?Al��OH��3+3H+��
�ʴ�Ϊ��Al3++3H2O?Al��OH��3+3H+��
��3��������ǿ�������Σ�̼�������ˮ�����Һ�ʼ��ԣ�CO32-+H2O?HCO3-+OH-�����������´ٽ�����ˮ�⣬�Ӷ��ﵽ�����۵�Ŀ�ģ�
�ʴ�Ϊ��CO32-+H2O?HCO3-+OH-��
��4��NH4HSO4��Һ�У�H+����NH4+ˮ�⣬��NH4HCO3�У�HCO3-�Ȱ�ˮ������HCO3-ˮ��ʼ��ԣ���ٽ�NH4+ˮ�⣬��NH4��2SO4�к���2��笠����ӣ����ԣ�NH4��2SO4��NH4+��Ũ��������ԣ�NH4+��Ũ���ɴ�С˳��Ϊ��NH4��2SO4��NH4HSO4��NH4Cl��NH4HCO3�����ܣ��ۣ��٣��ڣ�
�ʴ�Ϊ���ܣ��ۣ��٣��ڣ�
���� ���⿼���������ˮ�⣬������ض�ѧ������֪ʶ��ѵ���ͼ��飬����������ѧ��������û���֪ʶ���ʵ���������������Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȫ��ͨ����ֽ | B�� | �ж����ЧӦ | ||
| C�� | ���ײ�����ͨ����Ĥ | D�� | �е�Ӿ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 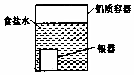 ����ͼװ�ô�����������ĺڰߣ�Ag2S�����������淢���ķ�ӦΪAg2S+2e-�T2Ag+S2- | |
| B�� | 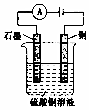 ��ͼװ�õ��һ��ʱ���ͭ�缫�����ܽ⣬��Һ��ͨ���ӵ�Ũ�Ȼ������� | |
| C�� | 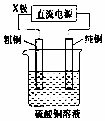 ��ͼװ������ֱ����Դ��X��Ϊ���������װ�ÿ�ʵ�ִ�ͭ�ĵ�⾫�� | |
| D�� | 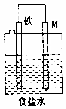 ��ͼ��ͼ����M��ͭ�����װ���ܷ�ֹ������ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʹ������������˺�̫���ܵ�� | |
| B�� | ���ͷ����Ҫ�ɷ�������غ����ʣ��ֱ����ڵ���ʺͷǵ���� | |
| C�� | �ڳ����¿�������������������Ũ���� | |
| D�� | BaSO4�������ᣬ���Կ�����ϡ�����Ba��NO3��2��Һ����SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ������ | X�Լ� | ���ӷ���ʽ |
| A | Fe2+��Na+��SO42-��Cl- | ��ˮ | 2Fe2++I2�T2Fe3++2I- |
| B | pH=8����Һ�У�Na+��HCO3-��Cl- | ��������ʯ��ˮ | Ca2++2OH-+2HCO3-�TCaCO3��+2H2O+CO32- |
| C | ����Һ�У�NH4+��Fe3+��Cl-��AlO2- | ����ͭ�� | Cu+2Fe�T2Fe2++Cu2+ |
| D | K+��Na+��SO42-��ClO- | ����SO2 | 2Cl-+SO2+H2O�T2HClO+SO32- |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al��OH��3�ֽ� | B�� | CO2+OH- | C�� | Al+OH-+H2O | D�� | Al2O3+OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| ������ | 300 | 0.3 | 0.1 | / | 0.02 |
| ������ | 300 | 0.6 | 0.2 | / | / |
| ������ | 240 | 0.3 | 0.1 | / | 0.01 |
| A�� | �÷�Ӧ������Ӧ���� | |
| B�� | ����ƽ��ʱ����������SO2��ת���ʱ�������Ĵ� | |
| C�� | 240��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1.08��104 | |
| D�� | ����ƽ��ʱ���������е�����Ӧ���ʱ��������еĴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���ڷ�Ӧ��H2��g��+Cl2��g��=2HCl ��g����H=-a kJ/mol�������ƻ��ɻ�ѧ�����յ��������γ��»�ѧ���ͷŵ������� | |
| B�� | 2MnO��s��+O2��g���T2MnO2��s�����÷�Ӧ�ڵ��������Է����У������H��0 | |
| C�� | �ø����pH��ֽ���ij��ˮ��pH=3.1 | |
| D�� | �����ڴ��е��ִ�ˮ���ϵIJ��ֱ�ˮ���µIJ��ָ�ʴ��������Ϊˮ�������绯ѧ��ʴ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com