
| A. | HClO的结构式:H-O-Cl | |
| B. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| C. | CH2F2的电子式: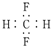 | |
| D. | Cl-的结构示意图: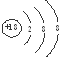 |
分析 A.次氯酸的中心原子是O元素,分子中含有1个H-O个和1个O-键;
B.质量数=质子数+中子数,元素符号的最简式为质量数、左下角为质子数;
C.该分子式中漏掉了F的3对未成键电子对;
D.氯离子的核电荷数为17,不是18.
解答 解:A.次氯酸分子中O原子分别与H、Cl原子之间之间形成1对共用电子对,故HClO的结构式为H-O-Cl,故A正确;
B.质子数为92、中子数为146的U原子的质量数为238,该原子正确的表示方法为:92238U,故B错误;
C.CH2F2的电子式中,氟原子最外层达到8电子稳定结构,其正确的电子式为: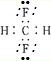 ,故C错误;
,故C错误;
D.氯离子的核电荷数为17,核外电子总数为18,该离子正确的离子结构示意图为: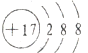 ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及离子结构示意图、电子式、结构式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 | |
| B. | 充电时,A为阴极,发生还原反应 | |
| C. | 放电时,B为正极,电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+H+═H2O | B. | OH-+CO32-+2H+═HCO3-+H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1molH2O的体积约为22.4L | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2 NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 | |
| D. | 若恒容、恒温下充入CO,则K值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO${\;}_{4}^{-}$、Cl- | B. | K+、Ag+、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Ba2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | D. | Na+、Cu2+、NO${\;}_{3}^{-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L CCl4所含的原子数为0.5 NA | |
| B. | 0.5 mol O2含氧原子数为0.5NA | |
| C. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 氧气和臭氧的混合物16 g中约含有NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com