
| A. | OH-+H+═H2O | B. | OH-+CO32-+2H+═HCO3-+H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
分析 向浓度均为1mol/L的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸,先发生反应NaOH+HCl=NaCl+H2O,然后发生反应Na2CO3+HCl=NaCl+NaHCO3,此过程中没有气体生成,最后发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,据此判断反应的离子方程式.
解答 解:A.加入稀盐酸后,氢氧化钠优先反应,反应的离子方程式为:OH-+H+═H2O,所以该反应能够发生,故A不选;
B.当加入的盐酸不足时,氢氧化钠先与盐酸反应生成氯化钠和水,然后碳酸钠与盐酸反应生成碳酸氢钠,反应的总离子方程式为:OH-+CO32-+2H+═HCO3-+H2O,该反应能够发生,故B不选;
C.当盐酸过量时,氢氧化钠和碳酸钠都完全反应,反应的总离子方程式为:OH-+CO32-+3H+═CO2↑+2H2O,该反应能够发生,故C不选;
D.氢离子足量时,氢氧根离子与碳酸根离子的物质的量应该相等,不可能发生反应:2OH-+CO32-+4H+═CO2↑+3H2O,故D选;
故选D.
点评 本题考查了离子方程式的书写与判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确发生反应的先后顺序为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
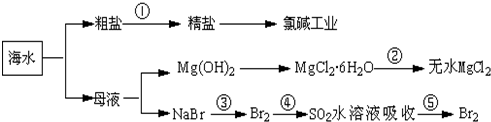
| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程④中SO2被还原 | |
| C. | 从第③步到第⑤步的目的是为了浓缩 | |
| D. | 从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
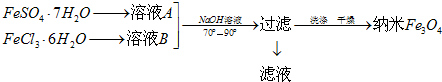
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-O-Cl | |
| B. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| C. | CH2F2的电子式: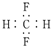 | |
| D. | Cl-的结构示意图: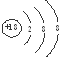 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直接用酒精灯的外焰加热蒸发皿 | |
| B. | 加热过程中不断用玻璃棒搅拌 | |
| C. | 加热到液体全部消失 | |
| D. | 蒸发皿中出现多量晶体、少量液体时,停止加热,利用蒸发皿的余热烘干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中最多有4种离子 | B. | 若溶液有颜色,则一定没有OH-、I- | ||
| C. | 若溶液呈碱性,则一定含有Na+ | D. | 该溶液不可能溶解单质铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{22.4}$mol/L | B. | $\frac{1}{11.2}$mol/L | C. | $\frac{1}{5.6}$mol/L | D. | $\frac{1}{33.6}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com