
分析 (1)根据反应物、生成物书写方程式,该反应中N元素化合价由+3价变为+2价、+5价,根据硝酸和转移电子之间的关系式计算;
(2)根据氧化剂氧化性强于氧化产物氧化性分析;
(3)反应中生成NO,NO易与空气中氧气反应生成红棕色的NO2气体,同时形成酸雾;
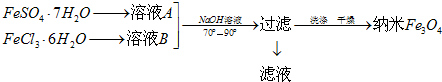
(4)硫酸亚铁易被氧化为硫酸铁,硫酸亚铁为强酸弱碱盐,易发生水解,FeSO4•7H2O和FeCl3•6H2O在氢氧化钠溶液中生成四氧化三铁、水、氯化钠;根据电荷守恒可写出该方程式,根据方程式求解理论上FeSO4•7H2O和FeCl3•6H2O的物质的量之比;
(5)共沉淀法制备纳米级Fe3O4的关键为FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,Fe2+易被氧化为Fe3+,产品有杂质;
(6)根据题意磁流体分散系分散质粒子直径在10纳米以下,属于胶体的范畴,所以应具备胶体的性质,根据胶体的性质分析.
解答 解:(1)由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,NF3→NO,化合价降低1价,被还原,NF3→HNO3,化合价升高2价,被氧化,由方程式可知若反应中生成0.2mol HNO3,转移的电子的物质的量为0.2mol×(5-3)=0.4mol,转移的电子数目为0.4NA个,
故答案为:3NF3+5H2O=2NO+HNO3+9HF;0.4NA;
(2)由4NH3+3F2=NF3+3NH4F可知氧化剂:F2、氧化产物:NF3,所以氧化性F2>NF3,由3NF3+5H2O=2NO+HNO3+9HF可知氧化剂:NF3、氧化产物:HNO3,硝酸氧化性强于NO,所以氧化性NF3>NO,则氧化性F2>NF3>NO,
故答案为:F2>NF3>NO;
(3)NO易与空气中氧气反应生成红棕色的NO2气体,同时生成的HF和HNO3易结合空气中的水蒸气形成酸雾,有刺激性气味,
故答案为:产生红棕色气体,产生刺激性气味气体,产生白雾;
(4)硫酸亚铁易被氧化为硫酸铁,常加入少量铁粉防止亚铁离子被氧化,加入硫酸防止其水解,生成Fe3O4的反应物为Fe2+、Fe3+和OH-,根据电荷守恒可写出该离子方程式为Fe2++2Fe3++8OH-=Fe3O4+4H2O,化学方程式为FeSO4•7H2O+2FeCl3•6H2O+8NaOH=Fe3O4↓+17H2O+Na2SO4+6NaCl,FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,
故答案为:铁粉、硫酸;1:2;
(5)共沉淀法制备纳米级Fe3O4的反应为FeSO4•7H2O+2FeCl3•6H2O+8NaOH=Fe3O4↓+17H2O+Na2SO4+6NaCl,Fe2+易被氧化为Fe3+,无法控制FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,产品有杂质,
故答案为:Fe2+易被氧化为Fe3+,很难控制FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,产品含有杂质;
(6)根据题意磁流体分散系分散质粒子直径在10纳米以下,属于胶体的范畴,具备胶体的性质.
A.分散质粒子直径在10纳米以下,所得分散系为胶体,所以不是溶液,故A错误;
B.该分散性属于胶体,胶体可以通过渗析法得到提纯,故B正确;
C.该分散性属于胶体,胶体有丁达尔效应,所以当一束强光通过此磁流体时会出现光亮的通路,故C正确;
D.所得分散系为胶体,较稳定,属于介稳体系,故D正确;
故答案为:A.
点评 本题考查含氮、铁化合物的性质以及氧化还原反应,题目难度中等,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 按要求完成下列填空:
按要求完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+H+═H2O | B. | OH-+CO32-+2H+═HCO3-+H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| 物质鉴定试验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为CO32-、OH-,C、D、E中含有的阳离子为H+、Al3+、Ag+ |
| ②A溶液与E溶液反应,既有气体产生又有沉淀产生,A与C反应只有气体产生 | A为Na2CO3,C含H+ |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g 氦气中含有的分子数为NA | |
| B. | 常温常压下,22.4LCl2中含有的分子数为NA | |
| C. | 1L1mol/LK2SO4溶液中含有的钾离子数为NA | |
| D. | 1mol钠原子中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+HCl═NH4Cl | B. | 2H2O═2H2+O2 | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | C+H2O(g)═CO+H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com