
| A. | 该溶液中K+、Mg2+、H+、NO3-不能大量共存 | |
| B. | 溶液中的NH4+与Fe3+均发生水解反应,且相互促进 | |
| C. | 加入金属铜与Fe3+反应的离子方程式为:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 向其中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
分析 A.NH4Fe(SO4)2在溶液中电离出铵根离子、铁离子和硫酸根离子,四种离子之间不反应,都不与铵根离子、铁离子和硫酸根离子反应;
B.铵根离子和铁离子水解都生成氢离子,相互抑制水解;
C.铜与铁离子反应生成亚铁离子和铜离子,不会生成铁单质
D.硫酸根离子恰好沉淀时,硫酸铁铵与氢氧化钡的物质的量之比为1:2,据此写出反应的离子方程式.
解答 解:A.K+、Mg2+、H+、NO3-之间不反应,且都不与NH4Fe(SO4)2反应,在溶液中能大量共存,故A错误;
B.溶液中的NH4+与Fe3+均发生水解反应使溶液显示酸性,二者的水解是相互抑制的,故B错误;
C.加入金属铜与Fe3+反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故C错误;
D.向NH4Fe(SO4)2滴入Ba(OH)2溶液恰好使SO42-完全沉淀,铵根离子和铁离子也恰好反应,反应的离子方程式为:NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+NH3•H2O+Fe(OH)3↓,故D正确;
故选D.
点评 本题考查了离子共存的判断、离子方程式的书写及盐的水解原理及其影响等知识,题目难度中等,试题知识点较多,充分考查了学生的分析能力及灵活应用基础知识的能力,注意熟练掌握离子方程式的书写原则,明确判断离子方程式正误的常用方法.


科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列关于有机物的说法正确的是( )
A.有机物只能存在于动植物体内,不能通过人工的方法合成
B.有机物只含有碳、氢两种元素
C.含碳元素的化合物不一定属于有机物
D.烃是指燃烧后只生成CO2和H2O的有机物
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:实验题
实验题:
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
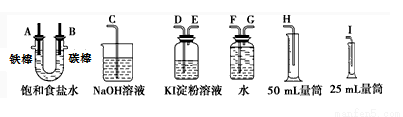
(1)A极发生的电极反应式是,B极发生的电极反应式是。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接、接;B接、接。
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为。
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8mL(标准状况)。此时溶液pH约为。(lg2=0.3,lg3=0.5,lg5=0.7)
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验。若甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的 电量为(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C,列式表示即可)。
电量为(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C,列式表示即可)。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48LHF,则转移0.8mol电子
D.还原剂与氧化剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:简答题
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为_________。
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O.研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是__________。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(如下图),产生该差异的可能原因是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D→E的反应类型取代反应.
;D→E的反应类型取代反应. .
. .
. )的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
)的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
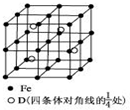 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
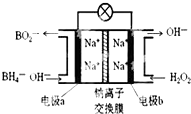 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com