
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显____(填“酸性、中性、或碱性”),理由是(用离子方程式表示):_______。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中(H+)_____(填“<”“>”或“=”)0.11mol/L,理由是____________。
(3)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为______________。
(4)某温度下,纯水中的c(H+)=4.0×10-7mol/L,若温度不变,滴入稀NaOH溶液,使c(OH-)=5.0×10-6moL/L,则溶液的c(H+)=______mol/L;pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa 溶波的pH_____NaOH溶液的pH(填“>”“=”或“<”);
II.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
(5)若处理后的废水中残留的c(Fe3+)=4.0×10-13mol/L,则残留的Cr3+的浓度为____mo/L(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-33)。
【答案】 碱性 A2-+H2O![]() HA-+OH- < H2A第一步电离产生的H+,抑制了HA-的电离 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 3.2×10-8 > 6×10-8
HA-+OH- < H2A第一步电离产生的H+,抑制了HA-的电离 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 3.2×10-8 > 6×10-8
【解析】(1)Na2A为强碱弱酸盐,水解显碱性,水解的离子方程式:A2-+H2O![]() HA-+OH-;正确答案:碱性;A2-+H2O
HA-+OH-;正确答案:碱性;A2-+H2O![]() HA-+OH-。
HA-+OH-。
(2)NaHA溶液pH=2,HA-电离显酸性,c(H+)=0.01mol/L;H2A分两步电离,0.1mol/L的H2A第一步完全电离出c(H+)=0.1 mol/L,第二步理论上HA-![]() H++A2-电离出c(H+)=0.01
H++A2-电离出c(H+)=0.01
mol/L,可是H2A第一步电离产生的H+,抑制了HA-的电离,0.1mol/L的H2A溶液中(H+)<
0.11mol/L;正确答案:< ;H2A第一步电离产生的H+,抑制了HA-的电离。
(3)0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,恰好完全反应生成NaHA溶液,该溶液电离显酸性,溶液中离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);正确答案:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
(4)纯水中的c(H+)= c(OH-)=4.0×10-7mol/L,KW=1.6×10-15;根据温度不变KW不变规律,可求出c(H+)= KW/ c(OH-)=1.6×10-15/5.0×10-6=3.2×10-8;CH3COONa溶液中存在水解平衡,升温平衡右移,碱性增强,而NaOH为强碱溶液,不存在电离平衡;所以CH3COONa溶液的pH大于NaOH溶液的pH;正确答案:3.2×10-8 ; > 。
(5)处理后的废水中残留的c(Fe3+)=4.0×10-13mol/L,Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)=4.0×10-38,带入数据进行计算得c3(OH-)=10-25,则残留的Cr3+的浓度为:Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-31,带入数据进行计算得c(Cr3+)=6×10-6 mol/L;正确答案:6×10-6。


科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=5.0×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列叙述错误的是
A. NaCN溶液中通人少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3-
B. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
C. 等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是__________;属于非电解质的是__________;能导电的有__________。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)____________________________。
②苏打和澄清石灰水反应(写出离子方程式)_______________________________
(3)配平下列氧化还原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名或主要成份与化学式相对应的是( )
A.苏打——NaHCO3B.生石灰 Ca(OH)2
C.漂白粉——Ca(ClO)2和CaCl2D.纯碱——NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中的四种物质,用一种试剂即可鉴别的是
A. 甲酸、乙醛、甲酸钠溶液、乙酸乙酯 B. 乙烯、乙烷、乙炔、丙烯
C. 苯酚、乙醇、苯、四氯化碳 D. 苯乙烯、苯酚、乙苯、甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为: N2(g)+H2(g)=2NH3(g) △H<0
(1)右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)

A.t1→t1 B.t2→t3 C.t3→t4 D.t5→t6
t4时改变的条件是________________。
进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L,则此时V正_____V逆 (填">"“<”或“=”)。
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。
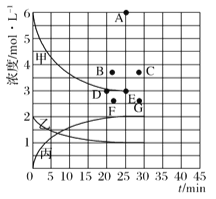
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL浓度均为3 mol·L-1的HNO3与H2SO4的混合溶液中加入1.92 g铜,充分反应后,设溶液体积仍为10 mL。求:
(1)产生的气体在标准状况下的体积是多少升_____?
(2)反应后溶液中各溶质的离子浓度是多少 ______? (反应完溶液中溶质的离子有Cu2+、H+、、NO3-、 SO42-)(以上要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项括号内为杂质,后面为除杂质操作,其中正确的是( )
A.乙酸乙酯(乙酸),加NaOH溶液、分液
B.福尔马林(乙酸),加Na2CO3溶液、分液
C.溴乙烷(乙醇),加水振荡、分液
D.苯(苯酚),加溴水振荡、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
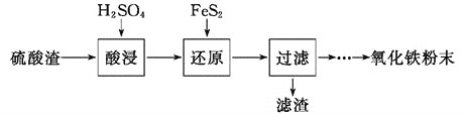
(1)“酸浸”中硫酸要适当过量,目的是___________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为___________。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定。有关反应的化学方程式如下:
2Fe3++Sn2++6Cl—=2Fe2++SnCl62—
Sn2++4Cl—+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
滴定时,K2Cr2O7标准溶液应盛放在滴定管中___________ (填“酸式”、“碱式”);若不加HgCl2,则测定的Fe3+量___________ (填“偏高”、“偏低”或“不变”)。
(4)①可选用___________ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是___________ (用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
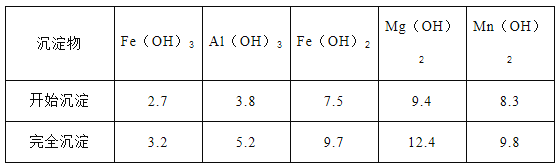
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:___________
a.氧化:。 b.沉淀:。 c.分离,洗涤。 d.烘干,研磨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com