
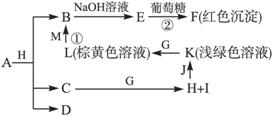
各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。
请回答下列问题:
(1)写出A的化学式_____________,C的电子式____________。
(2)比较Y与Z的原子半径大小___________ _>__________
_>__________ __(填写元素符号)。
__(填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示)____________,举出该反应的一个应用实例________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式:____________________________________。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称____________、____________、____________。
【答案】
(1)Cu2(OH)2CO3或CuCO3 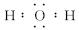
(2)C>O
(3)CH2OH(CHOH)4—CHO+2Cu(OH)2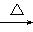 CH2OH—(CHOH)4—COOH+Cu2O↓+2H2O 医学上用于检验糖尿病
CH2OH—(CHOH)4—COOH+Cu2O↓+2H2O 医学上用于检验糖尿病
(4)3Cu2O+14HNO3(稀)====6Cu(NO3)2+2NO↑+7H2O
(5)金刚石 石墨 富勒烯(C60)
【解析】题干信息分析:“在周期表中X的原子半径最小”确定X是H元素。“G为黄绿色单质气体”确定G是Cl2。“反应①常用于制作印刷电路板”这个学生都熟悉,是Fe3+与Cu的反应。通过对框图信息分析:结合题干,K(浅绿色溶液)→L(棕黄色溶液)应是Fe2+→Fe3+。F是Cu2O沉淀。M是金属Cu,J是金属Fe。C是H2O,它与G(Cl2)反应生成的H是HCl,I是次氯酸(与题干中的“漂白作用”吻合)。B则是以CuCl2为主,生成的E是Cu(OH)2。A物质能与盐酸反应生成CuCl2和H2O,考虑D是无色非可燃性气体,应以CO2可能性较大。故符合题意的A可以是CuCO3,也可能是碱式碳酸铜。(1)A的化学式应写成“Cu2(OH)2CO3或CuCO3”。C的电子式是写H2O的电子式。(2)X是H元素,Y是C元素,Z是O元素,故此项应是“C>O”。(3)方程式是写新制Cu(OH)2与葡萄糖反应的,注意加热符号及沉淀符号。其应用就是在医学上检验糖尿病,即检验尿液中的葡萄糖。(4)考查方程式的书写,物质清楚,主要是配平问题可根据得失电子守恒配平。(5)气体D是CO2,注意问题中“被还原”这个关键词,确定N应是金刚石,其同素异形体主要有石墨、C60、碳纳米管等。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
0.1 mol/L HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
A.c(H+)>c(F-) B.c(H+)>c(HF)
C.c(OH-)>c(HF) D.c(HF)>c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
运用有关概念判断下列叙述正确的是( )
A.1 mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C.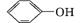 和
和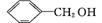 互为同系物
互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO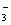 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② …… | 若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO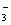 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂废水中含5.00×10-3 mol·L-1的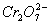 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁 性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
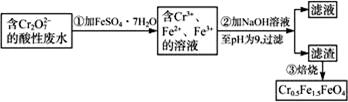
(1)第①步反应的离子方程式是____________________________________。
(2)第②步中用pH试纸测定溶液pH的操作是:__________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________________。
(4)欲使1 L该废水中的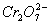 完全转化为Cr0.5Fe1.5FeO4,理论上需要加入_________g FeSO4·7H2O。
完全转化为Cr0.5Fe1.5FeO4,理论上需要加入_________g FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 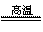 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
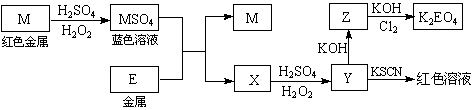
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
⑷由E制备的E(C2H5)2的结构如下图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: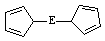 。核磁
。核磁 共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
警察常从案发现场的人体气味来获取有用线索。人体气味的成分中含有以下化合物:①辛酸;②壬酸;③环十二醇;④5,9十一烷酸内酯;⑤十八烷;⑥己醛;⑦庚醛。下列说法正确的是( )
A.①②⑥分子中碳原子数小于10,③④⑤分子中碳原子数大于10
B.①②是无机物,③⑤⑦是有机物
C.①②是酸性化合物,③⑤不是酸性化合物
D.②③④含氧元素,⑤⑥⑦不含氧元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com