
【题目】【化学——选修3:物质结构与性质】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式 , 。
(2)铜元素基态原子的电子排布式为 ,铜单质晶体中的原子堆积模型属于 堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是 (填元素符号),第一电离能最大的是 (填元素符号)。该晶体中的阴离子的立体构型是 ,阴离子的中心原子的杂化方式为 。
(4)氨的沸点 (填“高于”或“低于”)膦(PH3),原因是 。

(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是 。若该晶体的密度为ρg·cm-3,以NA表示阿伏加德罗常数,则该晶胞的边长为a= nm。
【答案】(1)Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4 NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O(2分)
(2)1s22s22p63s23p63d104s1或[Ar] 3d104s1(1分) 面心立方最密堆积(1分)
(3)O(1分) N(1分) 正四面体(1分) sp3(1分)
(4)高于(1分) 因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点(1分)(5)CuCl(1分) 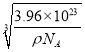 (2分)
(2分)
【解析】
试题分析:(1)根据实验过程和实验现象可知实验前两步反应的离子方程式分别为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4 NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(2)铜元素的原子序数是29,基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar] 3d104s1,铜单质晶体中的原子堆积模型属于面心立方最密堆积堆积。
(3)非金属性越强,电负性越大,则在上述深蓝色晶体所含的非金属元素中,电负性最大的是O,氮元素的2p轨道电子处于半充满状态,稳定性强,则第一电离能最大的是N。该晶体中的阴离子是氯酸根离子,中心原子S原子的价层电子对数是4,且不存在孤对电子,所以其立体构型是正四面体,阴离子的中心原子的杂化方式为 sp3。
(4)因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点。
(5)晶胞中氯原子的个数是4个,铜原子的个数是8×1/8+6×1/2=4,所以化学式为CuCl。根据m=Vρ可知a3ρ=![]() ,解得a=
,解得a=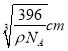 =
=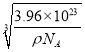 nm。
nm。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】某元素原子的价电子构型是3s23p4,则它在周期表中的位置是
A. 第四周期ⅡA族 B. 第三周期ⅣA族
C. 第三周期ⅥA族 D. 第二周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关水在人体中的作用,下列说法不正确的是( )
A.水是一种很好的溶剂 B.水在人体内还有调节体温的作用
C.饮用水越纯净对身体越好 D.水是反应介质和反应物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉与漂白液可用于杀菌消毒,下列说法中正确的是
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成分是Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是

A. R的氧化物都含有离子键
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 重结晶法一般适用于被提纯有机物在溶剂中的溶解度受温度影响较大的混合物的分离
B. 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同
C. 在乙炔实验室制取过程中,为了减缓电石与水的反应速率,实验时常滴加饱和食盐水
D. 催化重整是获得芳香烃的主要途径
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com