
 �о���ѧ��Ӧԭ�����������������������������Ҫ���壮
�о���ѧ��Ӧԭ�����������������������������Ҫ���壮| c2(SO3) |
| C2(SO2)��C(O2) |
| (1.5-0.5)mol |
| 2L |
| 1mol |
| 2L |
| 1mol |
| 2L |
| c2(SO3) |
| C2(SO2)��C(O2) |
| (0.5mol/L)2 |
| (0.5mol/L)2��(0.5mol/L) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2010?Ϋ��һģ���о���ѧ��Ӧԭ���������������Ǻ�������ģ�
��2010?Ϋ��һģ���о���ѧ��Ӧԭ���������������Ǻ�������ģ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�о���ѧ��Ӧԭ���������������Ǻ�������ġ�
��1�����й��ڴ����������ȷ���� ����д���ţ���
a���������pH�Ĵ����������ȫ��NaOH��Һ�кͣ�����NaOH�����ʵ���һ����
b���������Һ�м���һ����NaOH���壬��Һ�ĵ�������ǿ
c����ˮϡ�ʹ�����Һ����Һ�е���������Ũ�Ⱦ���С
d�������£�������Һ��ˮ�ĵ���̶ȱȴ�ˮ��С
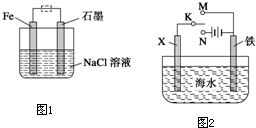
��2���������������洦�ɼ��������ĵ绯��ʴԭ����ͼ��ʾ��
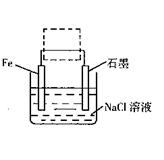
��д��ʯī�缫�ĵ缫��Ӧʽ ��
�ڽ���װ�������ļ��ɳ�Ϊ�����绯ѧ������װ�ã�������ͼ���߿�����ʾλ�������ġ�
��д���ĺ�ʯī�缫�ĵ缫��Ӧʽ ��
��3���ٸ�¯���������лᷢ����Ӧ��FeO��s��+CO��g��![]() Fe��s��+CO2��g����
Fe��s��+CO2��g����
��֪��Fe��s��+1/2O2��g��=FeO��s����H= -272kJ��mol-1
C��s��+O2��g��=CO2��g�� ��H= -393��5kJ��mol-1
2C��s��+O2��g��=2CO��g�� ��H= -22lkJ��mol-1
��FeO��s��+CO��g��![]() Fe��s��+CO2��g��
Fe��s��+CO2��g��
��H= ��
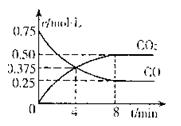
��һ���¶��£���ij�ܱ������м�������FeO��
������һ������CO���壬��Ӧ������CO��CO2��
Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��ӿ�ʼ���ﵽƽ������У�![]() ��CO��= ��
��CO��= ��
��4��������һ�ֺ�ɫ���ϣ���ɷ���Fe2O3����һ��������������160mL 5mol��L-1�����У��ټ���һ��������ǡ����ȫ�ܽ⣬�ռ�������2.24L����״����������⣬��Һ����Fe3+����μӷ�Ӧ�����۵�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�����ʡ֣������������ѧ�ڵڶ����¿������ۣ���ѧ���� ���ͣ������
�о���ѧ��Ӧԭ���������������Ǻ�������ġ�
��1�����й��ڴ����������ȷ���� ����д���ţ���
a���������pH�Ĵ����������ȫ��NaOH��Һ�кͣ�����NaOH�����ʵ���һ����
b���������Һ�м���һ����NaOH���壬��Һ�ĵ�������ǿ
c����ˮϡ�ʹ�����Һ����Һ�е���������Ũ�Ⱦ���С
d�������£�������Һ��ˮ�ĵ���̶ȱȴ�ˮ��С
��2���������������洦�ɼ��������ĵ绯��ʴԭ����ͼ��ʾ��
��д��ʯī�缫�ĵ缫��Ӧʽ ��
�ڽ���װ�������ļ��ɳ�Ϊ�����绯ѧ������װ�ã�������ͼ���߿�����ʾλ�������ġ�
��д���ĺ�ʯī�缫�ĵ缫��Ӧʽ ��
��3���ٸ�¯���������лᷢ����Ӧ��FeO��s��+CO��g�� Fe��s��+CO2��g����
Fe��s��+CO2��g����
��֪��Fe��s��+1/2O2��g��=FeO��s����H= -272kJ��mol-1
C��s��+O2��g��=CO2��g�� ��H= -393��5kJ��mol-1
2C��s��+O2��g��=2CO��g�� ��H= -22lkJ��mol-1
��FeO��s��+CO��g�� Fe��s��+CO2��g��
Fe��s��+CO2��g��
��H= ��
��һ���¶��£���ij�ܱ������м�������FeO��
������һ������CO���壬��Ӧ������CO��CO2��
Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��ӿ�ʼ���ﵽƽ������У� ��CO��= ��
��CO��= ��
��4��������һ�ֺ�ɫ���ϣ���ɷ���Fe2O3����һ��������������160mL 5mol��L-1�����У��ټ���һ��������ǡ����ȫ�ܽ⣬�ռ�������2.24L����״����������⣬��Һ����Fe3+����μӷ�Ӧ�����۵�����Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com