
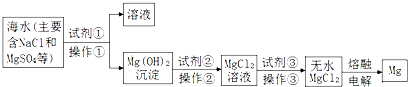
| A. | 试剂①可以选用的试剂是熟石灰,操作①的方法是过滤 | |
| B. | 试剂②可以选用的试剂是盐酸 | |
| C. | 操作③是直接将MgCl2溶液加热蒸发得到无水MgCl2晶体 | |
| D. | 无水MgCl2在通电时发生电离,电解后得到单质Mg. |
分析 海水中加入试剂①氢氧化钙沉淀镁离子生成氢氧化镁沉淀,操作①为过滤操作,过滤后在氢氧化镁沉淀中加入试剂②盐酸溶解,得到氯化镁溶液,通过操作③浓缩蒸发,冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到无水氯化镁,电解熔融氯化镁得到金属镁;
A.试剂①可以选用的试剂是熟石灰,沉淀镁离子,分离固体和溶液的操作方法是过滤;
B.分析可知试剂②是盐酸溶解氢氧化镁沉淀;
C.氯化镁溶液水解生成氢氧化镁和氯化氢,蒸发氯化氢挥发促进水解得到氢氧化镁沉淀;
D.氯化镁加热熔融电离,不需要通电;
解答 解:海水中加入试剂①氢氧化钙沉淀镁离子生成氢氧化镁沉淀,操作①为过滤操作,过滤后在氢氧化镁沉淀中加入试剂②盐酸溶解,得到氯化镁溶液,通过操作③浓缩蒸发,冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到无水氯化镁,电解熔融氯化镁得到金属镁;
A.分析可知试剂①可以选用的试剂是熟石灰,用来沉淀镁离子,分离固体和溶液的操作方法是过滤,故A正确;
B.分析可知试剂②是盐酸溶解氢氧化镁沉淀,故B正确;
C.氯化镁溶液水解生成氢氧化镁和氯化氢,蒸发氯化氢挥发促进水解得到氢氧化镁沉淀,不能得到氯化镁晶体,故C错误;
D.氯化镁加热熔融电离,不需要通电,故D错误;
故选AB.
点评 本题考查了海水资源的分析应用,主要是海水提镁的过程分析判断,注意氯化镁溶液蒸发浓缩会促进水解,题目难度中等.


科目:高中化学 来源: 题型:多选题
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为Y<X<W<Z | |
| B. | Y的单质和Z的单质能够发生反应 | |
| C. | X的单质都是熔点高、硬度大的物质 | |
| D. | 工业上利用电解Z、W的熔融氯化物的方法制备对应的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅢA族的B和Al都能形成+3价的化合物 | |
| B. | ⅤA族的N和P都能形成-3价的化合物 | |
| C. | ⅠA族的Na和K都能形成+1价的化合物 | |
| D. | ⅦA族的F和Cl都能形成+7价的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
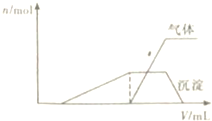 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑧ | C. | ③⑤⑥⑦⑧ | D. | ③④⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
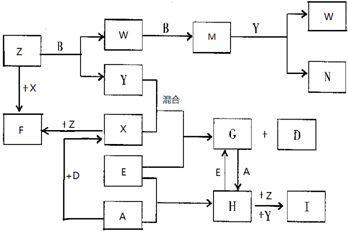
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)=c(CH3COO-)的盐酸和醋酸溶液 | |
| B. | 水的电离程度相同的稀硫酸和盐酸 | |
| C. | 水的电离程度相同的氯化按溶液和硫酸铜溶液 | |
| D. | 铵根离子浓度相同的硫酸铵和硫酸氢铵溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com