
| A、NH3 | B、H2 | C、Cl2 | D、SO2 |


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
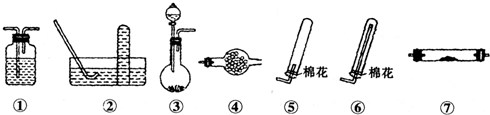
| 物质 | 熔点/℃ | 沸点℃ | 化学性质 | ||||
| S | 112.8 | 444.6 | 略 | ||||
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S;300℃以上完全分解; S2Cl2+Cl2
|
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

(1)写出A、B两试管中的实验现象:
A__________________________________、__________________________________(两种即可);B__________________________________。
(2)充分反应后,发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,若使剩余铜片溶解,可再加入物质的化学式为____________________。
(3)测定剩余硫酸的物质的量时,先测铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量。他认为测定SO2的量的方法有多种,下列方案中不可行的是( )
A.将A产生的气体干燥后缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称量
B.将A产生的气体缓缓通入稀硫酸酸化的KMnO4溶液,加足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.将A产生的气体缓缓通入足量用HNO3酸化的Ba(NO3)2溶液,充分反应过滤、洗涤、干燥、称量沉淀
D.用排饱和NaHSO3溶液的方法测出干燥后装置A产生SO2气体的体积(已折算成标准状况)
(4)向反应后的溶液中加入足量的氧化铜,使剩余的硫酸转化为硫酸铜,过滤后将滤液加热浓缩,冷却制得硫酸铜晶体(CuSO4·xH2O),用加热法测定该晶体里结晶水x的值。其中一次实验的数据为:
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.7 | G | 11.7 |
根据数据计算,判断x的实测值比理论值(x=5)_________(填“偏大”或“偏小”),实验中产生误差的原因可能是_________(填字母编号)。
A.硫酸铜晶体中含有不挥发杂质
B.加热失水后露置在空气中冷却
C.加热时有晶体飞溅出去
D.硫酸铜晶体(CuSO4·xH2O)在称量前晶体的表面吸收了水分
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省宁波市十校联考理综化学试卷(解析版) 题型:选择题
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S  Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。

Ⅰ.现按如下方法制备Na2S2O3·5H2O:
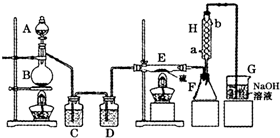
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为 ,
装置6中可放入 。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液

(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+S Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液PH要控制不小于7理由是
(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:

(1)为减少产品的损失,操作①为 ,操作②是抽滤洗涤干燥,其中洗涤操作是用
(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高
(3)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准
确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加
水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴
淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,滴定终点的现象为
三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液
的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
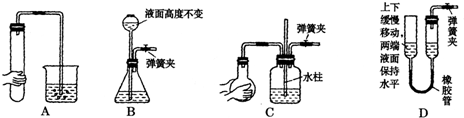
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请把导管补充完整。(在原图中画即可)
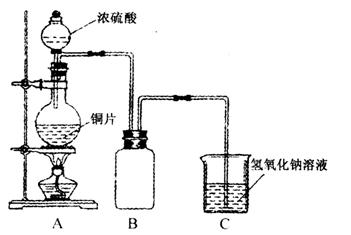
(2)实验中他们取6.4 g铜片和12 mL18 mol·1-1浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_________________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:____________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:_________________(填写字母编号)。
A.铁粉 B.BaCl2溶液
C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______________________(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的用稀硫酸酸化的KMnO4溶液,再加入足量的BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况下)
D.将装置A产生的气体缓缓通入足量的氢氧化钡溶液中,反应完全后,过滤、洗涤、干燥,称最沉淀
②乙学生没计的方案是:向反应后的溶液中加蒸馏水稀释至1000 mL,取20 mL于锥形瓶中,滴入2—3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生没计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“否”),其理由是_______。
(4)请再设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com