
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1) Z、W形成的气态氢化物的稳定性为___________>___________,(填化学式)写出下列元素的名称:X_______、W_______,Z、M、W三种元素离子半径由大到小的顺序是 _________ (填相应的离子符号)。
(2) 由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,写出该反应的化学反应方程式________________,若有19.2g铜参加反应则会生成标准状况下气体体积为________。
(3) 用电子式表示M2W的形成过程_____________________________________________
(4) 由M、Z两元素形成的原子个数比为1∶1化合物的电子式为__________________ ,化学键类型是__________________
(5) 由X、Y、Z、W四种元素组成的一种盐A,已知:①1molA能与足量NaOH浓溶液反应生成标准状况下22.4L气体。②A能与盐酸反应产生气体B,该气体能与溴水反应。写出A的化学式_______________________________,该气体B与溴水反应的离子方程式____________。
【答案】H2O H2S 氢 硫 r(S2-)>r(O2-)>r(Na+) 3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑ 4.48L ![]()
![]() 离子键 非极性键 NH4HSO3 SO2+Br2+2H2O=4H++2Br-+SO42-
离子键 非极性键 NH4HSO3 SO2+Br2+2H2O=4H++2Br-+SO42-
【解析】
原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素。M元素与X同主族,与W同周期,则M为Na。
(1) 非金属性越强,气态氢化物越稳定,同一主族从上到下非金属性减弱, Z、W形成的气态氢化物的稳定性为H2O>H2S;根据上面分析可知X为H、W为S;比较半径①电子层越多,半径越大;②电子层相同,核电荷数越大,吸电子能力越强,半径越小。则Z、M、W三种元素离子半径由大到小的顺序是r(S2-)>r(O2-)>r(Na+);
答案:H2O H2S 氢 硫 r(S2-)>r(O2-)>r(Na+)
(2) 由X、Y、Z、W四种元素中的三种组成的一种强酸,想到硫酸和硝酸,但是该强酸的稀溶液能与铜反应,所以确定为硝酸,该反应的化学反应方程式3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑;
若有19.2g铜参加反应则会生成标准状况下气体体积:
3Cu + 8HNO3(稀)=3Cu(NO3)2+4H2O + 2NO↑;
3×64g 2×22.4L
19.2g V(NO)
V(NO)=![]() L=4.48L
L=4.48L
(3) 硫化钠为离子化合物,用电子式表示M2W(Na2S)的形成过程为![]() ;
;
答案:![]()
(4) 由M、Z两元素形成的原子个数比为1∶1化合物为Na2O2,电子式为![]() ,化学键类型是离子键和非极性键;
,化学键类型是离子键和非极性键;
答案:![]() 离子键 非极性键
离子键 非极性键
(5) H、N、O、S四种元素组成盐A①1molA能与足量NaOH浓溶液反应生成标准状况下22.4L气体,因为铵盐遇碱放氨气,确定为铵盐,1mol盐含1mol铵根离子。②A能与盐酸反应产生气体B,该气体能与溴水反应,确定为还原性亚硫酸盐或亚硫酸的酸式盐。确定A的化学式NH4HSO3,该气体B与溴水反应的离子方程式SO2+Br2+2H2O=4H++2Br-+SO42-;
答案:NH4HSO3 SO2+Br2+2H2O=4H++2Br-+SO42-


科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体的熔点:![]() >
>
B. 晶格能的大小: Al2O3>MgCl2>NaCl
C. 共价键的键长: F-F>C-Cl>C-S>Si-O
D. 硬度由大到小:金刚石>氮化硅>晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO![]() 在酸性条件下的氧化性强弱,设计实验如下:
在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:__________________________。
(2)实验②的化学反应中转移电子的物质的量是___________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO![]() 的氧化性由弱到强的顺序是________________。
的氧化性由弱到强的顺序是________________。
Ⅱ.(4)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]() 。
。
①能说明该反应已达到平衡状态的标志是________________。
a.反应速率 v(![]() )=v(
)=v(![]() )
)
b.容器内压强不再随时间而发生变化
c.容器内 ![]() 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
d.容器内 n(NO)∶n(![]() )∶n(
)∶n(![]() )∶n(
)∶n(![]() ) = 6∶4∶5∶6
) = 6∶4∶5∶6
e.12mol N-H键断裂的同时生成 5mol N≡N 键
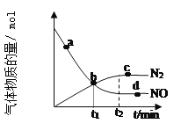
②某次实验中测得容器内 NO 及![]() 的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是 v(正 )_____v(逆);d 点对应的速率关系是 v(正)_____v(逆)。
的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是 v(正 )_____v(逆);d 点对应的速率关系是 v(正)_____v(逆)。
(填﹥、﹤或﹦)
(2)一定条件下,在 2L 密闭容器内,反应![]() ,n(
,n(![]() )随时间 变化如下表:
)随时间 变化如下表:
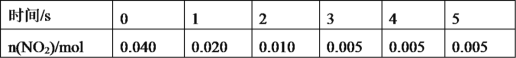
①用![]() 表示 0~2 s 内该反应的平均速率为_____。在第 5s 时,
表示 0~2 s 内该反应的平均速率为_____。在第 5s 时,![]() 的转化率为______。
的转化率为______。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
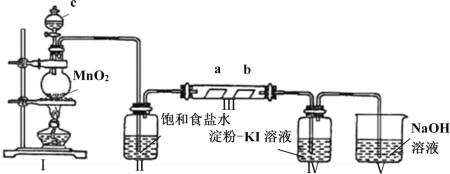
(1)装置Ⅰ中仪器c的名称是_______________,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为_______________________________________________________。
(2)装置Ⅱ的作用是________________________。
(3)实验过程中装置Ⅳ中的实验现象为______________________________。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与III之间添加下图中的_______装置(填序号)。

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。
(实验一)实验步骤如下:
向新制的Na2S溶液中滴加新制的氯水
设计该实验方案的目的是:探究同周期元素的性质递变规律。
(1)实验①的现象是_____________________,反应的离子方程式是_________________。
(实验二)为验证Cl、Br的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.
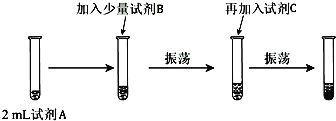
(2)试剂A是NaBr溶液,试剂B是氯水,加C后出现分层,则试剂C是____________.
(3)加入C振荡、静置后看到的现象是:______________________________________。以上反应可以证明Cl的非金属性__________(填“强于”或“弱于”)Br的非金属性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有德国重离子研宄中心人工合成的第112号元素的正式名称为“Copemicium”,相应的元素符号位“Cn”,该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:
![]() 。下列叙述中正确的是
。下列叙述中正确的是
A. 上述合成过程中属于化学变化
B. Cn元素的相对原子质量为277
C. ![]() 的原子核内中子数比质子数多53
的原子核内中子数比质子数多53
D. Cn元素位于元素周期表的第六周期,是副族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com