
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是( )

A. 含16g氧原子的二氧化硅晶体中含有的σ键数目为2NA
B. 58.5g NaCl晶体中含有0.25NA个如图所示的结构单元
C. 含1mol水分子的冰晶体中氢键数为4NA
D. 常温常压下,5g2D2O含有的质子数、电子数、中子数均为2.5NA
【答案】C
【解析】
A.二氧化硅晶体中,每个硅原子形成4价,邻近两个硅原子之间插入一个氧原子,因而每个硅原子形成4个Si-O单键,即4个σ键,根据含16g氧原子的二氧化硅易算出SiO2为0.5mol,因而含有的σ键数目为4×0.5NA=2NA,A正确;
B.根据晶胞图易算出一个NaCl晶胞中含有4个Na+和4个Cl-,58.5g NaCl为0.1mol,0.1molNaCl含0.1NA个Na+和0.1NA个Cl-,晶胞数等于0.1NA/4=0.25NA,B正确;
C.一个H2O分子中形成两个O-H单键,O原子存在两对孤对电子,因而可以与其他水分子形成两个氢键,含1mol水分子的冰晶体中氢键数为2NA,C错误;
D.1个2D2O分子中含有1×2+8=10个质子,电子数等于质子数,为10个电子,而中子数等于(2-1)×2+16-8=10 ,2D2O摩尔质量为20g/mol,5g2D2O为0.25mol,因而5g2D2O含有的质子数10×0.25 NA=2.5NA、电子数10×0.25 NA=2.5NA、中子数为10×0.25 NA=2.5NA,D正确。
故答案选C。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+ B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
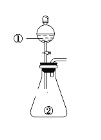
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液(H2C2O4具有还原性) | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁红涂料中添加有CuO或FeO中的一种,为探究添加物的成分设计如下实验方案。
(1)请写出实验步骤、预期现象,对应的离子方程式。
(限选试剂:铁粉、3mol/LH2SO4、0.1mol/L酸性KMnO4溶液、10%H2O2、KSCN溶液)

①_____________,②_____________,_____________,③___________,_____________
④操作步骤③中反应的离子方程式为____________。
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验。
已知:气体由草酸晶体受热分解得到:H2C2O4·2H2O ![]() CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。
CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。

①装置A、B中的试剂依次是_____、______。
②气体通入后,接下来的操作是____,然后对C装置加热。
③实验前后称得D装置增重8.8g,则此铁红中铁的质量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些原子的2p能级和3d能级中电子排布的情况。其中违反了洪特规则的是( )
① ![]() ②
② ![]() ③
③ ![]() ④
④ ![]() ⑤
⑤![]()
A. ①②B. ①②③C. ②④⑤D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是______________________________。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C.KNO3溶液 D.Na2SO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
③2min内Y的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰干电池的构造如图所示,其电池反应的方程式为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)下列说法不正确的是( )

A.石墨作正极
B.锌发生氧化反应
C.电池工作时,电子从石墨经导线流向锌
D.正极的电极反应为:NH4++MnO2+e-=MnO(OH)+NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=+57.3 kJ·mol-1
B. 在101 kPa下H2(g)的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
C. 已知CH3OH的燃烧热为726.8 kJ·mol-1,则有CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
D. 已知9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g FeS时放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com