【答案】
分析:(1)①先根据反应中能量变化求出参加反应的CO
2的物质的量,然后再根据v=
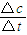
求出CO
2的平均反应速率;
②首先计算出平衡时各物质的浓度,根据K=
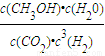
计算;
③恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值;
④要使n(CH
3OH)/n(CO
2)增大,应使平衡向正反应方向移动;
(2)①甲醇发生氧化反应,在碱性条件下生成碳酸根与水;
②图1中原电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl
-在阳极放电生成氯气,阴极Cu
2+放电生成Cu:Cu
2++2e
-=Cu,故图2中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t
1前电极反应式为:阳极2Cl
--4e
-=Cl
2↑,阴极2Cu
2++4e
-=2Cu,t
1~t
2电极反应式为:阳极4OH
--4e
-=O
2↑+2H
2O,阴极2Cu
2++4e
-=2Cu,t
2点后电极反应式为:阳极4OH
--4e
-=O
2↑+2H
2O,阴极4H
++4e
-=2H
2↑,所以t
1~t
2 阳极上生成氧气,根据氧气的量计算氢氧根离子的物质的量,水电离出等物质的量的氢离子和氢氧根离子,根据公式计算得出C(H
+),从而得出溶液的pH.
解答:解:(1)①1mol二氧化碳完全反应放出49.0kJ热量,当放出29.4kJ热量时,则参加反应的n(CO
2)=
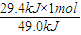
=0.6mol,CO
2的平均反应速率v=
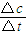
=
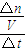
=
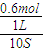
=0.06mol/(L?S),故答案为:0.06mol/(L?S);
②CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)
初始(mol/L) 1 3 0 0
转化(mol/L) 0.6 1.8 0.6 0.6
平衡(mol/L) 0.4 1.2 0.6 0.6
根据K=
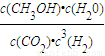
=
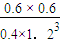
=0.12,
故答案为:0.12;
③恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值,则吸收的热量=反应热-放出的热量=49.0kJ-29.4kJ=19.6kJ,
故答案为:19.6;
④要使n(CH
3OH)/n(CO
2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度,平衡向逆反应方向移动,则n(CH
3OH)/n(CO
2)减小,故A错误;
B.充入氢气,平衡向正反应方法移动,n(CH
3OH)/n(CO
2)增大,.故B正确;
C.将水蒸气从体系中分离,平衡向正反应方法移动,n(CH
3OH)/n(CO
2)增大,故C正确;
D.用更有效的催化剂,平衡不移动,则n(CH
3OH)/n(CO
2)不变,故D错误.
故答案为:BC;
(2)①甲醇燃料电池中,在碱性条件下,甲醇失电子生成碳酸根与水,电极反应式为:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O,故答案为:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O;
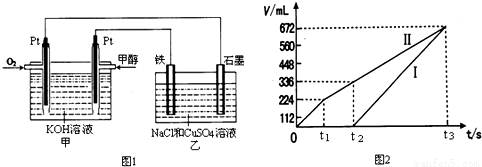
②图1中乙中石墨电极为阳极、铁电极为阴极,开始Cl
-在阳极放电生成氯气,阴极Cu
2+放电生成Cu:Cu
2++2e
-=Cu;故图2中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t
1前电极反应式为:阳极2Cl
--4e
-=Cl
2↑,t
1~t
2电极反应式为:阳极4OH
--4e
-=O
2↑+2H
2O,t
2点后电极反应式为:阳极4OH
--4e
-=O
2↑+2H
2O,所以在t
1后,石墨电极上的电极反应式为4OH
--4e
-=O
2↑+2H
2O;t
1~t
2电极反应式为:阳极4OH
--4e
-=O
2↑+2H
2O,阴极2Cu
2++4e
-=2Cu,t
2点后电极反应式为:阳极4OH
--4e
-=O
2↑+2H
2O,阴极4H
++4e
-=2H
2↑,所以t
1~t
2 阳极上生成氧气,t
1~t
2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH
-)=
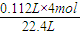
=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H
+)=0.02mol,c(H
+)=
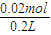
=0.1mol/L,所以溶液的pH=1,
故答案为:Cu
2++2e
-=Cu;4OH
--4e
-=O
2↑+2H
2O;1.
点评:本题考查了化学平衡的有关计算、电解池原理等知识点,电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,难度较大.

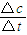 求出CO2的平均反应速率;
求出CO2的平均反应速率;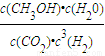 计算;
计算;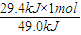 =0.6mol,CO2的平均反应速率v=
=0.6mol,CO2的平均反应速率v=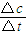 =
=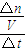 =
=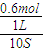 =0.06mol/(L?S),故答案为:0.06mol/(L?S);
=0.06mol/(L?S),故答案为:0.06mol/(L?S);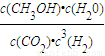 =
=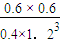 =0.12,
=0.12,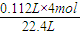 =0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=
=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=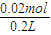 =0.1mol/L,所以溶液的pH=1,
=0.1mol/L,所以溶液的pH=1,


 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景. (2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.