
【题目】钠是人体中一种重要元素,一般情况下,钠约占成人体重的0.15%。钠元素对应的化合物因组成与结构性质差异很大。
(1)钠原子核外电子共占据_______个轨道,写出同一周期中原子核外M层上有2个未成对电子的元素其原子最外层电子排布式_______。
(2)氯化钠的熔点比氯化钾的_______(填“高”或“低”),原因是________。
(3)实验室可用浓氨水与氢氧化钠固体反应制取氨气,试用平衡原理分析氢氧化钠的作用:___。
(4)氟化钠溶液中,不存在的微粒间作用力是_________(填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力
(5)卡斯纳法制取金属钠的原理是:以氢氧化钠为原料,放入铁质容器中熔化,在稀有气体的保护下,以镍为阳极,铁为阴极,在阴极析出金属钠。写出反应的化学方程式为:_______。其中,氧化产物是:_____,若反应转移0.8mol电子,至少消耗______g NaOH。
【答案】6 3s23p2、3s23p4 高 二者都是离子晶体,钠离子与钾离子电荷相同,半径小于钾离子,导致氯化钠离子键更加牢固,熔点高 氢氧化钠是强电解质,溶于水增加了氢氧根浓度,且溶解过程放热,使平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-向逆反应方向移动,有利于氨气逸出 AC
NH4++OH-向逆反应方向移动,有利于氨气逸出 AC 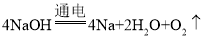 O2 32g
O2 32g
【解析】
(1)钠原子核外含有11个电子,电子排布式为1s22s22p63s1,s能级含有一个轨道,p能级有3个轨道,据此判断;原子核外M层上有2个未成对电子的元素即为3p2或者3p4,该元素为硅或硫元素,根据构造原理书写其原子最外层电子排布式;
(2)氯化钠和氯化钾为离子晶体,离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比、与电荷数成正比;
(3)浓氨水和氢氧化钠固体反应制取氨气,浓氨水滴入氢氧化钠固体,溶解放热,使一水合氨分解生成氨气;
(4)在氟化钠溶液中,存在氟离子、钠离子、氢离子、氢氧根离子和水分子,据此分析;
(5)电解熔融的氢氧化钠,钠离子在阴极得电子生成Na,氢氧根离子在阳极失电子生成氧气和水,根据反应物和生成物写出方程式,由化合价的变化以及氧化还原反应的概念判断。
(1)钠原子核外含有11个电子,电子排布式为1s22s22p63s1,s能级含有一个轨道,p能级有3个轨道,所以钠原子核外电子共占据了6个轨道;原子核外M层上有2个未成对电子的元素即为3p2或者3p4,该元素为硅或硫元素,所以其原子最外层电子排布式为3s23p2或者3s23p4;
(2)氯化钠和氯化钾为离子晶体,离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比、与电荷数成正比,钠离子半径小于钾离子,所以氯化钾的晶格能小于氯化钠,则氯化钠的熔点高于氯化钾;
(3)浓氨水滴入氢氧化钠固体,溶解放热,促使NH3的挥发,使一水合氨分解生成氨气,使NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-向生成NH3移动,加快氨气逸出;
NH4++OH-向生成NH3移动,加快氨气逸出;
(4)在氟化钠溶液中,存在氟离子,钠离子,氢离子,氢氧根离子和水分子,所以存在水分子间的范德华力和水分子内的氢氧共价键,所以不存在离子键和金属键,故合理选项是AC;
(5)电解熔融的氢氧化钠,钠离子在阴极得电子生成Na,氢氧根离子在阳极失电子生成氧气和水,则电极方程式为: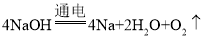 ,O元素的化合价升高,则氧气为氧化产物,反应中4mol氢氧化钠反应,转移4mol电子,则若反应转移0.8mol电子,消耗0.8mol NaOH,其质量为m(NaOH)=nM=0.8mol×40g/mol=32g。
,O元素的化合价升高,则氧气为氧化产物,反应中4mol氢氧化钠反应,转移4mol电子,则若反应转移0.8mol电子,消耗0.8mol NaOH,其质量为m(NaOH)=nM=0.8mol×40g/mol=32g。


科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示:
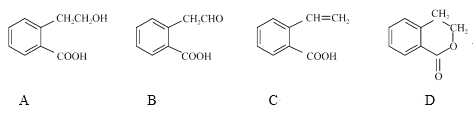
(1)A的分子式是____;B中的含氧官能团名称是____。
(2)A→B的反应类型是___;A~D中互为同分异构体的是___(填代号)。
(3)D在酸性条件下水解的化学方程式是____。
(4)B与足量新制Cu(OH)2悬浊液反应的化学方程式是___________。
(5)符合下列条件的A的同分异构体有____种。
①官能团与A完全相同且与苯环直接相连;②苯环上有三个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,还含有少量Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按如下流程进行生产,以制备金属镁。

本流程操作条件下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氧氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+后生成Fe(OH)3沉淀除去。 请回答以下问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施有 __________________________ (任写一条)。
(2)步骤②中NaClO的电子式为__________,加入NaClO溶液的目的是_________________________
(用离子方程式解释)。
(3)常温时,Mg(OH)2的Ksp=1.8×10-11。当溶液pH=10.0时,溶液中的c(Mg2+)=___________。
(4)若将步骤⑤中“稀盐酸”改为“加水、煮沸”的方式可以得到另一种沉淀物和一种无色无味的气体,请写出该反应的化学方程式__________________________________________。
(5)步骤⑥中涉及的操作是_____________________________,且⑥⑦操作均需在HCl气流中进行,其原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,下列说法正确的是
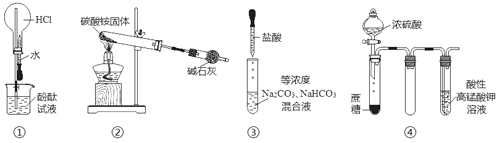
A. 实验①可观察到红色喷泉
B. 实验②可收集到少量氨气
C. 实验③中逐滴滴加稀盐酸时,试管中立即产生大量气泡
D. 实验④中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
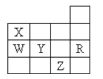
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在一定条件下转化为金刚石,其能量变化如图所示,其中ΔE1=393.5 kJ,ΔE2=395.4 kJ,下列说法正确的是

A. 1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量
B. 石墨转化为金刚石属于物理变化
C. 金刚石的稳定性强于石墨的
D. 1 mol金刚石的能量大于1 mol CO2的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
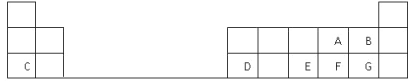
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是( )
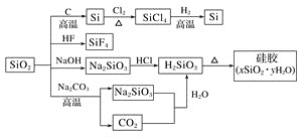
A.SiO2属于两性氧化物
B.盛放NaOH溶液的试剂瓶能用玻璃塞
C.硅胶吸水后可重复再生
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的分子式为C8H10,它滴入溴水中不能使溴水褪色,但它滴入酸性高锰酸钾溶液却能使其褪色。该有机物苯环上的一氯代物只有1种,则该烃是( )
A. 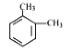 B.
B. ![]() C.
C. 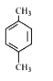 D.
D. 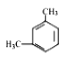
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com