
【题目】如图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是( )
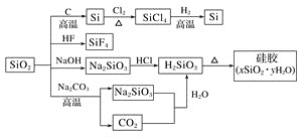
A.SiO2属于两性氧化物
B.盛放NaOH溶液的试剂瓶能用玻璃塞
C.硅胶吸水后可重复再生
D.图中所示转化反应都是氧化还原反应
【答案】C
【解析】
A.与酸或碱反应生成盐和水的氧化物,为两性氧化物,二氧化硅与NaOH反应:SiO2+2NaOH═Na2SiO3+H2O,生成了盐和水,SiO2能与HF反应:SiO2+4HF═SiF4↑+2H2O,生成物中没有盐,所以二氧化硅不是两性氧化物,只属于酸性氧化物,故A错误;
B.NaOH溶液呈强碱性,会与玻璃中的二氧化硅反应生成具有粘合性的硅酸钠,使玻璃塞无法打开,因此盛放NaOH溶液的试剂瓶不能使用玻璃塞,故B错误;
C.硅胶吸附水份后,可通过热脱附方式将水份除去,使得硅胶壳重复使用,故C正确;
D.图中二氧化硅与氢氟酸、氢氧化钠、碳酸钠的反应,硅酸钠与盐酸的反应,硅酸的分解,硅酸的生成,这些反应中元素的化合价都没有发生变化,是非氧化还原反应,故D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。

(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
【答案】 0.375 mol/(L·min) [NH3]2/[N2][H2]3 > bd < > [Cl-]= [NH4+]> [H+]= [OH-] 测量 0.1mol/L 氨水的 pH,pH小于13 等
【解析】试题分析:I.(1)根据![]() 计算反应速率;(2)根据平衡常数的定义书写平衡常数表达式;反应 N2(g)+3H2(g)
计算反应速率;(2)根据平衡常数的定义书写平衡常数表达式;反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动;(3)根据平衡状态的特征分析;II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸;根据电荷守恒分析离子浓度关系;(5)根据弱电解质部分电离或弱碱阳离子能水解设计方案;
2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动;(3)根据平衡状态的特征分析;II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸;根据电荷守恒分析离子浓度关系;(5)根据弱电解质部分电离或弱碱阳离子能水解设计方案;
解析:I.(1)2min内生成1mol氨气,则消耗氢气1.5mol, ![]() =
=![]() 0.375 mol/(L·min);(2)根据平衡常数的定义,平衡常数K=
0.375 mol/(L·min);(2)根据平衡常数的定义,平衡常数K=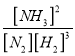 ;反应 N2(g)+3H2(g)
;反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动,平衡常数减小,所以K1>K2;(3)a.任意时刻速率比都等于系数比,所以3v(N2) = v(H2)不一定平衡,故a错误; b.N2(g)+3H2(g)
2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动,平衡常数减小,所以K1>K2;(3)a.任意时刻速率比都等于系数比,所以3v(N2) = v(H2)不一定平衡,故a错误; b.N2(g)+3H2(g)![]() 2NH3(g),气体物质的量是变量,所以压强是变量,容器内压强保持不变一定达到平衡状态,故b正确;c.根据
2NH3(g),气体物质的量是变量,所以压强是变量,容器内压强保持不变一定达到平衡状态,故b正确;c.根据![]() ,气体密度是恒量, 混合气体的密度保持不变不一定平衡,故c错误;d.25℃时K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,
,气体密度是恒量, 混合气体的密度保持不变不一定平衡,故c错误;d.25℃时K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,  ,Q=K,反应一定达到平衡状态,故d正确。
,Q=K,反应一定达到平衡状态,故d正确。
II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解![]() ,所以溶液呈酸性pH<7;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸,所以c>0.2;根据电荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以离子浓度关系为[Cl-]= [NH4+]> [H+]= [OH-];(5)测量 0.1mol/L 氨水的 pH,pH小于13 ,能证明一水合氨部分电离是弱电解质;
,所以溶液呈酸性pH<7;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸,所以c>0.2;根据电荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以离子浓度关系为[Cl-]= [NH4+]> [H+]= [OH-];(5)测量 0.1mol/L 氨水的 pH,pH小于13 ,能证明一水合氨部分电离是弱电解质;
点睛:同浓度、同体积的一元强酸与一元弱碱混合,溶液呈酸性;同浓度、同体积的一元弱酸与一元强碱混合,溶液呈碱性;同浓度、同体积的一元强酸与一元强碱混合,溶液呈中性。
【题型】综合题
【结束】
23
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:

已知:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
(1)虚线框处宜选择的装置是________(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是______________________。
(2)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_______溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由_________________。
实验二:
绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2 g,B为干燥管。按下图连接好装置进行实验。

实验步骤如下:(1)________,(2)点燃酒精灯,加热,(3)______,(4)______,(5)______,
(6)称量A, 重复上述操作步骤,直至 A 恒重,记为m3 g。
(3)请将下列实验步骤的编号填写在对应步骤的横线上
a.关闭 K1 和 K2 b.熄灭酒精灯 c.打开 K1 和 K2 缓缓通入 N2 d.冷却至室温
(4)必须要进行恒重操作的原因是_________________。
(5)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解, 根据实验记录,
计算绿矾化学式中结晶水数目 x=__________________(用含 m1、 m2、 m3的列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是人体中一种重要元素,一般情况下,钠约占成人体重的0.15%。钠元素对应的化合物因组成与结构性质差异很大。
(1)钠原子核外电子共占据_______个轨道,写出同一周期中原子核外M层上有2个未成对电子的元素其原子最外层电子排布式_______。
(2)氯化钠的熔点比氯化钾的_______(填“高”或“低”),原因是________。
(3)实验室可用浓氨水与氢氧化钠固体反应制取氨气,试用平衡原理分析氢氧化钠的作用:___。
(4)氟化钠溶液中,不存在的微粒间作用力是_________(填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力
(5)卡斯纳法制取金属钠的原理是:以氢氧化钠为原料,放入铁质容器中熔化,在稀有气体的保护下,以镍为阳极,铁为阴极,在阴极析出金属钠。写出反应的化学方程式为:_______。其中,氧化产物是:_____,若反应转移0.8mol电子,至少消耗______g NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的____极,发生的电极反应式为______; X电极上发生的电极反应为______;(填反应类型)
(3)外电路中的电子是从_______电极流向________电极。Ag+向_______ (填正极或负极)移动。
(4)当有1.6g铜溶解时,银棒增重_________________。
(5)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:H2+O2--2e-=H2O; B极:O2+4e-=2O2-。则A极是电池的______极;电子从该极____(填“流入”或“流出”),该电池的总反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
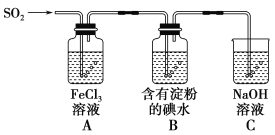
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一个碳原子上连有两个羟基时,易发生下列转化:![]() 。请根据如图回答:
。请根据如图回答:
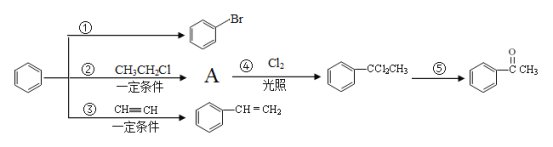
(1)物质A的化学式为C8H10,写出A的名称___,鉴别A和![]() 可选用的试剂是___。
可选用的试剂是___。
(2)写出反应①的化学反应方程式____。
(3)反应①~⑤中,属于加成反应的是____;反应⑤的反应条件为___。
(4)写出2种满足下列条件的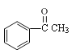 同分异构体的结构简式。___,____。
同分异构体的结构简式。___,____。
①含苯环结构 ②能发生银镜反应
(5)设计由![]() 制备
制备 ![]() 的合成路线(无机试剂任选)。_____
的合成路线(无机试剂任选)。_____
合成路线常用的表示方式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
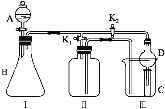
(1)打开K1关闭K2,可制取某些气体。甲同学认为装置Ⅰ可用于制取H2、NH3、O2,但装置Ⅱ只能收集H2、NH3,不能收集O2。其理由是_____。乙同学认为在不改动装置Ⅱ仪器的前提下,对装置Ⅱ进行适当改进,也可收集O2。你认为他的改进方法是_____。
(2)打开K2关闭K1,能比较一些物质的性质。丙同学设计实验比较氧化性:KClO3>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是______;仪器D在该装置中的作用是_______。在B装置中发生反应的离子方程式为______。丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是_____。
(3)实验室常用浓H2SO4与硝酸钠反应制取HNO3。下列装置中最适合制取HNO3的是_____。实验室里贮存浓硝酸的方法是_______。
a  b
b  c
c 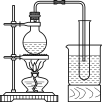 d
d 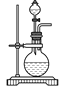
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com