
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
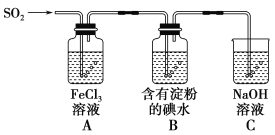
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
【答案】SO42- Fe2+ BD 吸收多余的二氧化硫,防止污染空气 SO2 + I2 +2H2O = 4H+ +SO42- +2I- ① SO2也能使酸性高锰酸钾溶液褪色
【解析】
二氧化硫与碘、Fe3+发生氧化还原反应,方程式分别为SO2+I2+2H2O=H2SO4+2HI,2Fe3++SO2+2H2O =2Fe2++SO42-+4H+,由于二氧化硫具有毒性,所以用氢氧化钠溶液进行尾气处理。实验室制备气体要求操作简便安全,产物单一或易于提纯。
(1)根据氧化还原反应原理,二氧化硫中的硫元素化合价升高,失去电子,发生氧化反应,故SO2气体和Fe3+反应的氧化产物是SO42-,F e3+被还原为Fe2+,还原产物是Fe2+;
(2)A.Na2SO3具有还原性,硝酸具有氧化性,Na2SO3与HNO3反应生成Na2SO4、NO和水,不能制备SO2;
B.Na2SO3固体与浓硫酸,利用浓硫酸的酸性,强酸制弱酸Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,产物单一,符合题意;
C.固体硫在纯氧中燃烧,产生二氧化硫,但是纯氧量无法控制,不用于实验室制备SO2;
D.铜与浓H2SO4共热,实验室制取二氧化硫的常用反应,Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,产物单一,符合题意。
CuSO4+SO2↑+2H2O,产物单一,符合题意。
综上所述,采用BD进行SO2的实验室制备。
(3)二氧化硫具有毒性,氢氧化钠与SO2发生反应,保护环境。装置C的作用是吸收多余的二氧化硫,防止污染空气;
(4)装置B中反应的离子方程式SO2 + I2 +2H2O = 4H+ +SO42- +2I-;
(5)A中的溶液,理论上包括溶于水的部分二氧化硫,反应产生的亚铁离子和硫酸根离子,同时溶液显酸性。方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去,说明溶液中存在能与MnO4-反应的物质,亚铁离子和二氧化硫都能将KMnO4还原,故不能确定是否发生了反应;方案②往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色,说明产生了氢氧化亚铁,在空气中迅速被氧化为红褐色氢氧化铁沉淀,说明A中含有亚铁离子,能说明二氧化硫与Fe3+发生了氧化还原反应;方案③往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀,白色沉淀为硫酸钡,说明溶液中有SO42-,二氧化硫被氧化,能说明二氧化硫与Fe3+发生了氧化还原反应。综上所述,上述方案不合理的是方案①,原因是SO2也能使酸性高锰酸钾溶液褪色。


科目:高中化学 来源: 题型:
【题目】常温下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/c(OH﹣) =1×10-12的溶液中:K+、Na+、![]() 、
、![]()
C. c(Fe2+)=1 molL-1的溶液中:K+、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
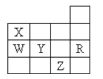
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
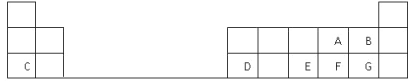
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 溶液中②、③点水的电离程度:③>②
C. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D. 该滴定过程应该选择甲基橙作为指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是( )
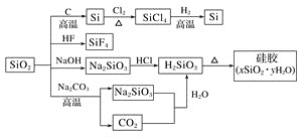
A.SiO2属于两性氧化物
B.盛放NaOH溶液的试剂瓶能用玻璃塞
C.硅胶吸水后可重复再生
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为______;
(2)5.4g H2O所含氢原子数目与_____L(标准状况)氨气所含氢原子数目相等;
(3)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下所示(反应条件及其他物质已经略去): A![]() B
B![]() C
C![]() D
D
a.若A是一种金属,C是淡黄色固体,写出C的一种用途________;
b.若A为淡黄色固体单质,实验室常用于检验B的试剂是__________;
c.若A是化合物,C是红棕色气体,则D的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在工农业生产中具有广泛应用,请回答下列问题:
(1)基态铬原子的核外电子排布式为_____________。
(2)Cr3+能形成配离子[Cr(H2O)(H2NCH2CH2NH2)]3+,在配体H2NCH2CH2NH2 中采用 sp3杂化的原子有_____。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与 CS2 等互溶.则固态 CrO2Cl2属于________晶体。已知 NO2+与 CS2 互为等电子体,则 1molNO2+中含有π键数目为 ____________
(4)Cr2O3 晶胞结构如图所示,已知 Cr2O3 的摩尔质量为 M g/mol,晶体的密度为ρ g·cm-3 ,晶胞体积为 V cm3. 晶胞结构示意图中的小黑球代表_____(填“铬离子”或“氧离子”),阿伏加德罗常数NA=_________mol-1(用含 M, V, ρ的代数式表示 )。
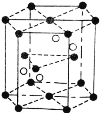
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
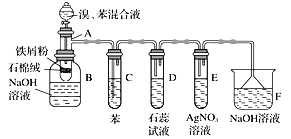
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯,发生反应。写出A中所发生反应的化学方程式:___________________________________________________________。
(2)试管观察D中看到的现象为____________________________________。
(3)在上述整套装置中,具有防倒吸作用的仪器有____________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com