
| A. | 离子化合物中一定不含共价键 | |
| B. | 共价化合物中一定不含离子键 | |
| C. | 全部由非金属元素形成的化合物一定是共价化合物 | |
| D. | 金属元素和非金属元素之间形成的化学键一定是离子键 |
分析 A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
B.只含共价键的化合物是共价化合物;
C.全部由非金属元素形成的化合物可能是离子化合物;
D.金属元素和非金属元素之间形成的化学键可能是共价键.
解答 解:A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,如KOH等,故A错误;
B.只含共价键的化合物是共价化合物,所以共价化合物中一定不含离子键,故B正确;
C.全部由非金属元素形成的化合物可能是离子化合物,如铵盐等,故C错误;
D.金属元素和非金属元素之间形成的化学键可能是共价键,如氯化铝等,故D错误;
故选B.
点评 本题考查化学键和化合物的关系,为高频考点,明确物质构成微粒及微粒之间作用力是解本题关键,采用举例法分析解答,注意规律中的特例,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸试剂可以做干燥剂,干燥任何气体 | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 常温下,2.7g Al与足量的稀硫酸反应得到H23.36L | |
| D. | 配制200mL 4.6mol•L-1的稀硫酸需取该硫酸50.0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;FHCOOCH=CH2;
;FHCOOCH=CH2;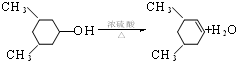 ; 反应④HCOOCH=CH2+H2O$→_{△}^{浓硫酸}$HCOOH+CH3CHO.
; 反应④HCOOCH=CH2+H2O$→_{△}^{浓硫酸}$HCOOH+CH3CHO.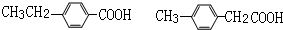 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z | Q |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 | -3、+5 |
 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1氨水中的NH4+ | |
| B. | 0.1mol Na2O2 所含的阴离子 | |
| C. | 12.5mL 16 mol•L-1的浓硫酸能溶解的Cu | |
| D. | 18g H2O中含NA个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | CH3CH2CHBrCH2Br | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com