
| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
分析 醋酸是弱电解质,醋酸溶液中存在醋酸的电离平衡,加水稀释醋酸促进醋酸电离,温度不变,醋酸的电离平衡常数不变,据此分析解答.
解答 解:A.加水稀释醋酸,促进醋酸电离,电离的氢离子最多,但是溶液的体积增大的程度大,所以溶液中氢离子浓度减小,则pH增大,故A错误;
B.醋酸的电离平衡常数,只与温度有关,加水稀释醋酸,醋酸的电离平衡常数不变,故B错误;
C.加水稀释醋酸,溶液的体积增大,溶液中离子浓度减小,导电性减弱,故C正确;
D.加水稀释醋酸,促进醋酸电离,所以电离程度增大,故D错误;
故选C.
点评 本题考查弱电解质的电离,明确稀释时电离平衡的移动及离子的物质的量、离子的浓度的变化是解答的关键,并注意离子积与温度的关系来解答,题目难度不大.


科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
足量块状铁与100 mL 0.01 mol/L的稀硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )。
①加H2O②加NaOH固体③加CH3COONa固体
④加Na2CO3固体⑤加入NaNO3固体⑥加NaCl溶液
⑦滴入几滴硫酸铜溶液⑧升高温度⑨将块状铁改为铁粉
⑩将稀硫酸改用98%的浓硫酸
A.⑧⑨⑩ B.⑦⑧⑨ C.③⑦⑩ D.⑦⑧⑩
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列名词中,哪个名词不属于物理量
A.长度 B.气体摩尔体积 C.摩尔 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定温度,相同浓度时电离平衡常数(K)越大可以表示弱电解质电离程度越大 | |
| B. | 电离平衡常数(K)与温度无关 | |
| C. | 不同浓度的同一弱电解质,其电离平衡常数(K)不同 | |
| D. | 多元弱酸各步电离平衡常数相互关系为K1<K2<K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加CH3COONa固体促进醋酸的电离 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
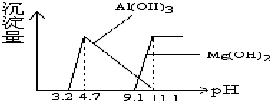 根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:
根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:| A. | Al(OH)3 和Mg(OH)2在水溶液中的电离过程完全相同 | |
| B. | 若改变溶液的pH,在pH<4.7时,n(Mg2+)几乎不变化 | |
| C. | 当pH>11.1时,溶液中只有NaCl和NaAlO2(Na[Al(OH)4]) | |
| D. | 等物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,氨水的pH与沉淀量关系与上图相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2(OH)- | D. | Na3PO4═3Na++PO43- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com