
 如图是一个化学过程的示意图.已知甲池的总反应式为:
如图是一个化学过程的示意图.已知甲池的总反应式为:分析 甲池为原电池,通入CH3OH的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,石墨为阳极,发生氧化反应,Fe极为电解池的阴极,发生还原反应,以此解答该题.
解答 解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;故答案为:原电池;
(2)乙有外加电源,所以是电解池.氢气发生氧化反应,所以该电极是负极,O2 发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以石墨电极B是阳极;
故答案为:阳极;
(3)通入CH3OH的电极为负极,发生氧化反应,Fe为电解池的阴极,银离子得电子被还原,电极方程式为4Ag++4e-═4Ag(或Ag++e-═Ag),通入氧气的一极为原电池的正极,发生还原反应,反应式为2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;4Ag++4e-═4Ag(或Ag++e-═Ag);
(4)乙池中离子放电顺序为:阳离子 Ag+>H+,阴离子OH->NO3 -,阴极电极反应为:O2+2H2O+4e-=4OH-;阳极电极反应为:4Ag++4e-=4Ag;依据电子守恒和电解的实质写出化学方程式:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(5)乙池中A(Fe)极发生Ag++e-═Ag,质量增加5.40g时,n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,转移0.05mol电子,则理论上消耗O2 $\frac{0.05}{4}$×22400mL=280ml.
故答案为:280.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子放电顺序是解本题关键,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | D中不可能是浓硫酸 | B. | 通入的氯气含有水蒸气 | ||
| C. | D中可以是水 | D. | D中可以是饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
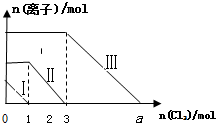 向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:
向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 不纯物 | 除杂试剂 | 分离方法 |
| A | C2H6(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯甲酸(s)(苯甲酸钠) | -- | 蒸馏 |
| C | 乙酸乙酯(甲酸) | Na2CO3溶液 | 分液 |
| D | 溴苯(溴) | CCl4 | 萃取分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10ml量筒量取8.58ml蒸馏水 | |
| C. | 容量瓶定容时观察液面时俯视,会使配得的溶液浓度偏大 | |
| D. | 用托盘天平可以称量至0.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,以任意比例混合的甲烷和乙烯混合物22.4 L充分燃烧,生成物中水的分子数为2NA | |
| B. | 标准状况下,11.2L辛烷完全燃烧后,所生成气态产物的分子数为4NA | |
| C. | 常温常压下,1mol苯中含有3NA碳碳双键、3NA碳碳单键 | |
| D. | 常温常压下,1 mol甲烷和1mol氯气光照反应生成2NA个气体分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 苯酚与碳酸钠溶液混合 | 醋酸与氯化钠溶液混合 | 苯酚与碳酸氢钠溶液混合 | CO2通入CaCl2溶液 |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com