
Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是
| IA | IIA | IIIA | IVA |
| | | | Q |
| X | | Y | |
D
解析试题分析:根据核外电子排布原理,设W、Z的电子数分别为2+x、2+8+x,则(2+x)×2=2+8+x,解得:x=6,说明W、Z分别是氧、硫,同主族元素的非金属性随核电荷数增大而减弱,则氧的非金属性比硫强,故A正确;读图可知元素在周期表中的位置,则X、Y、Q分别是钠、铝、碳,同周期主族元素的原子半径随核电荷数增大而减小,则原子半径:Na>Al>S,故B正确;同周期主族元素的金属性随核电荷数增大而减弱,则钠的金属性比铝强,由于金属性越强,最高价氧化物对应水化物的碱性越强,则碱性:NaOH>Al(OH)3,故C正确;同周期主族元素的非金属性随核电荷数增大而增强,则碳的非金属性比氧弱,由于非金属性越强,气态氢化物越稳定,则稳定性:CH4<H2O,故D错误。
考点:考查物质结构和元素周期律,涉及短周期主族元素的非金属性和金属性、原子半径、最高价氧化物对应水化物的碱性、氢化物稳定性的比较。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2- 的核外电子层结构相同。下列说法不正确的是
| A.原子序数:Y > X > Z |
| B.碱性:XOH > Y(OH)3 |
| C.单质的还原性:X > Y |
| D.离子半径:X+ > Y3+ > Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,正确的是
| A.I A族元素的金属性比ⅡA族元素的金属性强 |
| B.ⅥA族元素的氢化物中,最稳定的氢化物常温时为无色液体 |
| C.某主族元素X的气态氢化物化学式为HX,则其最高正价为+7价 |
| D.金属元素的原子只有还原性,金属阳离子只有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有A、B、C、D、E五种短周期元素,A是地壳中含量最多的元素,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是 ( )
A.离子半径:D+>C—
B.EA2是光导纤维的主要成分
C.A和B可以形成原子个数比1:1的化合物
D.以上元素中形成的最高价氧化物对应的水化物酸性最强的是C
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲、乙、丙、丁为四种主族元素,甲元素与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断正确的是
| A.原子半径:丙>乙>甲>丁 |
| B.气态氢化物的稳定性:甲>丙 |
| C.最高价氧化物对应的水化物的酸性:丁>甲 |
| D.乙和甲或乙和丁所能形成的化合物都是剧毒物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是部分短周期主族元素原子半径与原子序数的关系图。则下列说法正确的是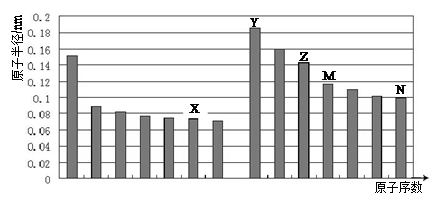
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的稳定性相比,前者较弱 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(2013梅州质检,22)某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表—种元素,其中O点代表氢元素。下列说法中不正确的是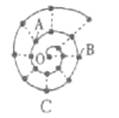
A.离0点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B、C最高价氧化物的水化物可相互反应
D.A、B组成的化合物中不可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列递变规律不正确的是( )
A.Na、Mg、Al还原性依次减弱 B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大 D.P、S、Cl最高正价依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
据科学家预测,月球的土壤中吸附着数百万吨的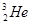 ,而在地球上氦元素则主要以
,而在地球上氦元素则主要以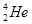 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.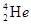 原子核内含有4个质子 原子核内含有4个质子 |
B.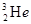 与 与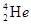 互为同位素 互为同位素 |
C.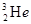 与 与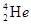 在元素周期表中占有不同的位置 在元素周期表中占有不同的位置 |
D.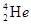 的最外层电子数为2,故 的最外层电子数为2,故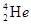 易失去最外层电子 易失去最外层电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com