
【题目】某学生用0.1000 mol/L NaOH溶液滴定未知浓度的盐酸溶液,操作可分解为如下几步:
A.用蒸馏水洗干净滴定管;B. 用待测定的溶液润洗酸式滴定管;C.用酸式滴定管取稀盐酸20.00 mL,注入锥形瓶中,加入酚酞;D.另取锥形瓶,再重复操作一次;E.检查滴定管是否漏水;F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)_____________。
(2)操作F中应该选择图中________滴定管(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应观察________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是____________________________。
(4)滴定结果如表所示:
滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20 | 1.02 | 21.03 |
2 | 20 | 2.00 | 25.00 |
3 | 20 | 0.60 | 20.60 |
滴定中误差较大的是第________次实验,造成这种误差的可能原因是________。
A. 碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B. 滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C. 滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D. 达到滴定终点时,仰视溶液凹液面最低点读数
E. 滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为________mol/L。
(6)如果准确移取20.00 mL 0.1000 mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?________(填“是”或“否”)。
【答案】EABCFGD 乙 B 无色变浅红色且半分钟内不褪色 2 A、B、D 0.100 0 是
【解析】
(1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(2)根据碱式滴定管的结构判断;
(3)根据滴定操作的要求和终点判断的方法分析解答;
(4)第2次实验误差较大,根据错误操作导致标准液体积变大分析原因;
(5)先判断数据的有效性,然后求出平均值,最后根据关系式HCl~NaOH来计算出盐酸的浓度;
(6)根据关系式HCl~NaOH来计算出盐酸的浓度。
(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为EABCFGD,故答案为:EABCFGD;
(2)滴定管乙下端是橡皮管,为碱式滴定管,故答案为:乙;
(3)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中颜色变化,酚酞遇碱变红,滴定终点溶液颜色的变化是无色变浅红色且半分钟内不褪色,故答案为:B;无色变浅红色且半分钟内不褪色;
(4)第2次实验误差较大,错误操作导致标准液体积偏大。A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次,导致浓度变小,所用溶液体积偏大,故A正确;B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡,导致读数偏大,故B正确;C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡,导致读数偏小,故C错误;D.达到滴定终点时,仰视溶液凹液面最低点读数,导致读数偏大,故D正确;E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来,导致所用碱液减少,故E错误;故答案为:2;ABD;
(5)数据2无效,取1、3体积进行计算,所用标准液的平均体积为![]() mL≈20.00mL,
mL≈20.00mL,
HCl~~~~~~~~~NaOH
1 1
c(HCl)×20.00mL 0.1000mol/L×20.00mL
c(HCl)=![]() =0.1000mol/L,故答案为:0.1000;
=0.1000mol/L,故答案为:0.1000;
(6)准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,通过盐酸的体积,根据HCl~NaOH来计算出盐酸的浓度,故答案为:是。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A. MnS的![]() 比CuS的
比CuS的![]() 大
大
B. 该反应达到平衡时:![]()
C. 往平衡体系中加入少量![]() 固体后,
固体后,![]() 变大
变大
D. ![]() 的浊液中加入少量可溶性
的浊液中加入少量可溶性![]() 固体后,
固体后,![]() 变大
变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、氯、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题。
(1)二氧化氯(ClO2)已逐步代替Cl2用于自来水处理,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。已知:25 ℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性HClO2________HClO(填“>”“=”或“<”);在pH=5的上述处理过的饮用水中![]() =___________;若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,写出酸性条件下该反应的离子方程式:____________________________________________________________。
=___________;若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,写出酸性条件下该反应的离子方程式:____________________________________________________________。
(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,下图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6,溶液中存在的金属阳离子为____________(当溶液中金属离子浓度≤10-5mol·L-1时,可认为沉淀完全)。

②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=______________________。
(3)Na2S是常用的重金属离子沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是________________;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-1),此时的S2-浓度为___________________________。已知:Ksp(FeS)=6.3×10-18;Ksp(CuS)=6×10-36;Ksp(PbS)=2.4×10-18。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2![]() 2NH3。下列有关说法正确的是:
2NH3。下列有关说法正确的是:
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
C.达到化学平衡时,反应则停止进行
D.达到化学平衡时,N2和H2生成速率比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图回答,下列说法不正确的是

A. 此装置用于铁表面镀铜时,a为铁
B. 此装置用于电镀铜时,硫酸铜溶液的浓度不变
C. 燃料电池中正极反应为O2+4e-+4H+![]() 2H2O
2H2O
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
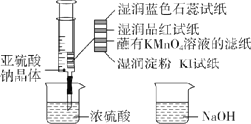
A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉-KI试纸未变蓝说明SO2的氧化性强于I2
D.品红试纸、蘸有KMnO4溶液的滤纸褪色都体现了SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。

金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_______________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是__________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是____(请简述理由,并且写出对应的离子反应方程式)。
(3)步骤Ⅲ,合适的pH范围是____________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序_____________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_______方式进行冷却结晶。

A. 快速降温 B. 缓慢降温 C. 变速降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年国庆阅兵上,新一代预警机、无人机、东风![]() 战略核导弹等一批国产武器装备精彩亮相、震撼人心。它们不仅是捍卫国家安全和民族尊严的利器,更是我们每个中国人幸福生活的保障。导弹、装备的制造和化学密不可分,请配平下列方程式:
战略核导弹等一批国产武器装备精彩亮相、震撼人心。它们不仅是捍卫国家安全和民族尊严的利器,更是我们每个中国人幸福生活的保障。导弹、装备的制造和化学密不可分,请配平下列方程式:
(1)______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]()
(2)______![]() ______
______![]() ______S↓______
______S↓______![]() ______
______![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应的改进实验操作如下:取一张滤纸,用酚酞试液浸润并晾干,裁剪并折叠成信封状,滤纸内放一小块(约绿豆粒般大小)金属钠,把含钠的滤纸信封放入水中,装置如下图所示。

请回答:
(1)写出金属钠与水反应的离子方程式________________。
(2)实验过程中取用金属钠的操作方法是________________。
(3)有关此实验的说法正确的是________________。
A.实验过程中,可能听到爆鸣声
B.实验过程中,看到滤纸信封由白色逐渐变红色
C.实验改进的优点之一是由实验现象能直接得出反应产物
D.实验过程中,多余的金属钠不能放回原试剂瓶中,以免对瓶内试剂产生污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com