
【题目】某铁柱需长期浸入水下,为了减少腐蚀,下列措施中不能达到目的是
A.在铁柱上铆上一些锌片B.将铁柱与直流电源的正极相连
C.在铁柱表面涂上一层较厚的沥青D.在铁柱表面镀锡
科目:高中化学 来源: 题型:
【题目】pH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )
①若 a<4,则A、B都是弱酸
②稀释后,A酸溶液的c(H+ )比B酸溶液c(H+ )大
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.

A. ①④ B. ②③ C. ①② D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A. 还原剂中必定有一种元素被氧化
B. 在氧化还原反应中,失去电子的元素化合价降低
C. 物质中某元素失去电子,则此物质是氧化剂
D. 物质所含元素化合价升高的反应叫还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.摩尔是用于计量微观粒子集体的物理量
B.CO2的摩尔质量为44g
C.0.5mol水中约含6.02×1023个H
D.标准状况下1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1=-285.8kJ/mol
C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH3=-5518kJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图所示。

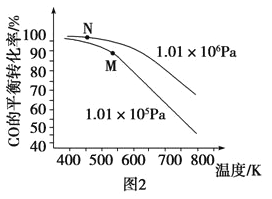
①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为__________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
③工业实际合成CH3OH生产中,采用图2中M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源.制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题.
(1)用甲烷制取氢气的两步反应的能量变化如图所示: 
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
②第Ⅱ步反应为可逆反应.800℃时,若CO的起始浓度为2.0molL﹣1 , 水蒸气的起始浓度为3.0molL﹣1 , 达到化学平衡状态后,测得CO2的浓度为1.2molL﹣1 , 则CO的平衡转化率为 .
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2 , 且反应前后B元素的化合价不变,该反应的化学方程式为 , 反应消耗1mol NaBH4时转移的电子数目为 .
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢. 
在某温度下,向恒容容器中加入环已烷,其起始浓度为a molL﹣1 , 平衡时苯的浓度为b molL﹣1 , 该反应的平衡常数K=(用含a、b的关系式表达).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx . 已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJmol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJmol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为 .
(2)利用反应6NO2+8NH3 ![]() 7N2+12H2O处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为: .
7N2+12H2O处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为: .
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g);△H<0.该反应的化学平衡常数表达式为K= , 该反应△S0(填“>”或“<”)若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将移动(填“向左”、“向右”或“不”).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是(填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42﹣而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若以溴乙烷为主要原料制备乙二酸,则经过的最佳途径反应顺序为
A.取代—消去—加成—氧化B.消去—加成—取代—氧化
C.消去—取代—加成—氧化D.取代—加成—氧化—消去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com