
【题目】“碳捕捉技术”常用于去除或分离气流中的二氧化碳。
Ⅰ.2017年,中国科学家在利用二氧化碳直接制备液体燃料领域取得了突破性进展,其中用二氧化碳制备甲醇(CH3OH)的反应如下图:

(1)A的化学式为_________。
(2)该反应说明CO2具有___________性(填“氧化”或“还原”)。若有1mol甲醇生成,转移电子的物质的量为_________________mol。
Ⅱ.利用NaOH溶液“捕提"CO2的基本过程如下图(部分条件及物质已略去):
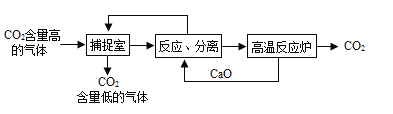
(1)反应分离室中,发生反应的化学方程式分别为CaO+H2O=Ca(OH)2和__________________
(2)高温反应炉中,涉及反应的化学反应类型为_______________________。
(3)整个过程中,可以循环利用物质的化学式为__________________。
【答案】H2O 氧化 6 NaHCO3 + Ca(OH)2 = NaOH + CaCO3↓ + H2O (或Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓ ) 分解反应 NaOH CaO
【解析】
根据反应中元素化合价的变化分析物质的氧化性和还原性,并计算转移的电子数;根据题干信息及图示分析每步过程中发生的化学反应,进而分析反应的类型及过程中可循环利用的物质。
Ⅰ.(1)根据反应的图示及质量守恒得:A为水,化学式为H2O,
故答案为:H2O;
(2)二氧化碳中碳元素化合价为+4,甲醇中碳元素化合价为-2,化合价降低,CO2发生还原反应,所以二氧化碳具有氧化性;反应中,氢元素的化合价由0升高为+1价,有1mol甲醇生成时,3molH2参加反应,转移电子的物质的量为3mol×2=6mol,
故答案为:氧化, 6;
Ⅱ.(1)由题干及图示知,氢氧化钠吸收二氧化碳生成碳酸钠或碳酸氢钠,分离室中还会分离出氢氧化钠,所以还存在的反应是:Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓或NaHCO3 + Ca(OH)2 = NaOH + CaCO3↓ + H2O,
故答案为:NaHCO3 + Ca(OH)2 = NaOH + CaCO3↓ + H2O (或Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓ ;
(2)根据图示,高温反应炉中发生的反应是碳酸钙分解生成氧化钙和二氧化碳,化学反应类型为分解反应,
故答案为:分解反应;
(3)根据图示,参加反应且又生成的物质为可循环利用的物质,整个过程中,可以循环利用物质是氢氧化钠和氧化钙,化学式为NaOH、CaO,
故答案为:NaOH、CaO。


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氮的固定的化学反应是 ( )
A. N2与H2反应生成NH3 B. NO与O2反应生成NO2
C. NH3经催化氧化生成NO D. 由NH3制碳酸氢铵和碳酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是( )
A. 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
B. 通入SO2时,SO2与I2反应,I2作还原剂
C. 通入SO2与I2反应,I2作还原剂后溶液逐渐变成无色,体现了SO2的漂白性
D. 滴加KI溶液时,转移2 mol电子时生成1 mol白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,它的发现和研究经历了以下几个阶段。
(1)1774 年,舍勒在研究软锰矿(主要成分是二氧化锰)时,将软锰矿与浓盐酸混合并加热,无意间制得了氯气,此反应中氯元素被_______(填“氧化”或“还原”)
(2)贝托莱发现,氯气能溶于水,向此溶液中滴加紫色石蕊溶液,观察到的现象是_____________________。
(3)泰纳将氯气通入石灰水,并一步步改进,制得了我们现在常用的漂白粉,漂白粉的有效成分是__________________。
(4)盖吕萨克发现氯气能与金属反应。氯气与铝反应的化学方程式是_____________。
(5)1810 年,戴维经过大量实验研究,确认氯气是一种单质,且有毒。实验室吸收氯气的常用方法是___________________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为
Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2下列推断中正确的是
Fe(OH)2+2Ni(OH)2下列推断中正确的是
①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-==Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com