
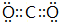 ,C原子成2个σ键,没有孤电子对,碳原子的杂化方式为sp,
,C原子成2个σ键,没有孤电子对,碳原子的杂化方式为sp, ;sp;
;sp; ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+ |
| C、氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
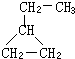 可表示为
可表示为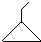 ,则金刚乙烷、金刚乙胺的结构简式可用下图表示.
,则金刚乙烷、金刚乙胺的结构简式可用下图表示.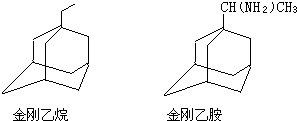
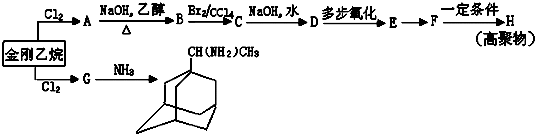
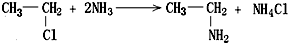
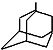 ,如金刚乙烷表示为R-CH2CH3)
,如金刚乙烷表示为R-CH2CH3)查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关性质或结构信息 |
| X | 基态原子的最外层电子排布式为nsnnpn |
| Y | 双原子分子单质在标准状况下密度为1.429g/L |
| Z | 所在周期的单核离子中半径最小 |
| W | 该元素原子有1个未成对的p电子 |
| T | 其单质和合金常用于航天工业和航海工业,其单质被誉为“21世纪金属”,其核外电子排布次外层电子数是最外层电子数的5倍 |
| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解、过滤、蒸发、洗涤 |
| B、溶解、过滤、洗涤、烘干 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、洗涤、过滤、烘干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从碘水中萃取碘,可选用酒精作为萃取剂 |
| B、萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应 |
| C、萃取后,静置分层,下层液体流出后,打开活塞,用另一只烧杯盛接剩余液体 |
| D、用四氯化碳萃取碘,静置后,上层接近无色,下层为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取碳酸钠晶体100 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 |
| D、定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、已知1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化如图1,则NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=+234kJ/mol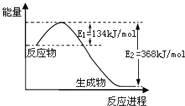 | ||||||||
B、一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| ||||||||
| C、已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液浓度为 5.6×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为 5×10-5 mol/L | ||||||||
D、在不同条件下进行的异构化反应 X?Y 的进程图解如下.图2中的“ ”是X,“ ”是X,“ ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小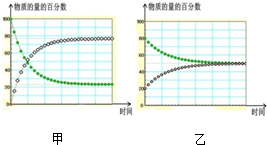 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com