
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
①0.5molO3与11.2LO2所含的分子数一定相等
②标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子数为3NA
③2L 1mol·L-1的盐酸中所含氯化氢分子数约为2NA
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤在2L0.1mol·L-1碳酸钠溶液中,阴离子总数大于0.2NA
⑥在反应KIO3+6HI===KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
⑦1mol羟基中电子数为10NA
⑧20gD2O含有的电子数为10NA
⑨7.8g 中含有的阴离子数为0.2NA
中含有的阴离子数为0.2NA
⑩8.7 g  与40 mL 10
与40 mL 10  的浓盐酸充分反应,生成的氯气分子数为0.1NA
的浓盐酸充分反应,生成的氯气分子数为0.1NA
A.①②④⑧ B.③⑥⑨⑩ C.④⑤⑧⑨ D.④⑤⑥⑧
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源:2017届湖北省高三上学期开学考试化学试卷(解析版) 题型:选择题
两种气态烃的混合气1 L,完全燃烧后,生成2 LCO2和2 L水蒸气(相同状况),则该混合烃的组合及其体积比是 ( )
A.CH4和C3H6,体积比2∶1 B.C3H8和C2H4,体积比2∶1
C.C2H6和C2H2,体积比1∶1 D.C2H6和C2H2,体积比2∶1
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上学期入学考试化学试卷(解析版) 题型:推断题
某溶液中可能含有Fe2+ 、Mg2+、Cu2+、NH4+、Al3+。当加入1 种淡黄色固体并加热时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。

(1)淡黄色固体是__________________________。
(2)可知溶液中一定没有的离子是 ,理由是 。
(3)请解释为什么在投入8mol淡黄色固体后,产生气体的量在减少 。
(4)写出淡黄色固体加入的量为8mol到10mol之间发生的所有离子方程式 。
(5)所含离子的物质的量之比为__________________________。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:选择题
下列有关实验操作说法中,正确的是( )
A. 配置1 L0.1 mol/L NaCl 溶液的实验中,用托盘天平称取 5.85g NaCl
B. 用广泛pH试纸测得橙汁pH为3.50
C. 用酸式滴定管量取25.00 mL高锰酸钾溶液
D. 可用过滤的方法除去淀粉溶液中混有的少量NaCl杂质
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:选择题
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的摩尔体积比乙的摩尔体积小
B.甲的物质的量比乙的物质的量多
C.甲的相对分子质量比乙的相对分子质量小
D.甲的分子数比乙的分子数少
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:填空题
雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(1)若在一定温度下,将1.0molNO、0.5molCO充入0.5L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8mol、0.3mol、0.2mol、0.1mol,该反应的化学平衡常数K= ;若保持温度不变,再向容器中充入CO、N2各0.3mol,平衡将 移动(填“向左”、“向右”或“不”)。
(2)CO可以合成甲醇。已知:
①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H=-1529kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1;
③2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1;
则CO(g)+2H2(g) CH3OH(g) △H= kJ·mol-1。
CH3OH(g) △H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
取铜、镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896LNO2气体和0.672LN2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
A.1:1 B.2:1 C.3:2 D.2:3
查看答案和解析>>
科目:高中化学 来源:2017届湖北省沙市高三上学期第三次考试化学试卷(解析版) 题型:选择题
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A: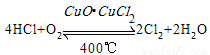
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.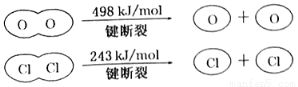
判断下列说法正确的是
A.反应A的△H>-115.6kJ·mol-1
B.H2O中H—O键比HCl中H—Cl键弱
C.由II中的数据判断氯元素的非金属性比氧元素强
D.断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期摸底考试理综化学试卷(解析版) 题型:填空题
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
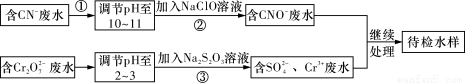
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:_________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每消耗0.4 mol Cr2O72-转移________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是:___________________,___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com