
取铜、镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896LNO2气体和0.672LN2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
A.1:1 B.2:1 C.3:2 D.2:3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届湖北省高三上学期8月月考化学试卷(解析版) 题型:选择题
普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性.根据这一特点科学家发明了电动势(E)法测水泥初凝时间,此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag.下列有关说法不正确的是( )
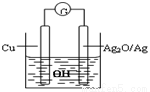
A.工业上制备普通水泥的主要原料是黏土和石灰石
B.测量原理装置图中,Ag2O/Ag极发生氧化反应
C.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
D.在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:推断题
如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
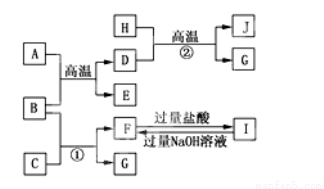
根据图示回答问题:
(1)写出下列物质的化学式: C ,E ,I ,J 。
(2)反应①的离子方程式是_____________________;反应②的化学方程式是________________________;
(3)F与I反应的离子方程式是__________________;
(4)向一定体积的稀硫酸中加入少量的J固体,反应后的溶液与NaClO发生氧化还原反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
①0.5molO3与11.2LO2所含的分子数一定相等
②标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子数为3NA
③2L 1mol·L-1的盐酸中所含氯化氢分子数约为2NA
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤在2L0.1mol·L-1碳酸钠溶液中,阴离子总数大于0.2NA
⑥在反应KIO3+6HI===KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
⑦1mol羟基中电子数为10NA
⑧20gD2O含有的电子数为10NA
⑨7.8g 中含有的阴离子数为0.2NA
中含有的阴离子数为0.2NA
⑩8.7 g  与40 mL 10
与40 mL 10  的浓盐酸充分反应,生成的氯气分子数为0.1NA
的浓盐酸充分反应,生成的氯气分子数为0.1NA
A.①②④⑧ B.③⑥⑨⑩ C.④⑤⑧⑨ D.④⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
由氢氧化钠(NaOH)和过氧化钠(Na2O2)组成混合物中检测出氢元素的质量分数为1%,那么混合物中钠元素的质量百分数约为
A.46% B.57.5% C.58.4% D.无法计算
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
B.在含有0.1mol·L-1 Fe3+的溶液中:SCN-、Cl-、K+不能大量共存
C.在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小
D.常温下,水电离出c(H+)=10-10的溶液中:Na+、ClO-、S2-、NH4+不能大量共存
查看答案和解析>>
科目:高中化学 来源:2017届湖北省沙市高三上学期第三次考试化学试卷(解析版) 题型:实验题
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

(1)金属M为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)CoC2O4﹒2H2O高温焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其目的是 ,90℃时Ksp(Li2CO3)的值为 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省沙市高三上学期第三次考试化学试卷(解析版) 题型:选择题
有关氯气和氯水性质的叙述正确的是
A.使湿润KI淀粉试纸变蓝色的气体一定是氯气
B.饱和氯水久置时Cl-增多、水分子减少
C.过量的铁在氯气中燃烧可生成氯化亚铁
D.可用pH试纸测定氯水的pH
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期开学考试化学试卷(解析版) 题型:填空题
分氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
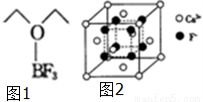
(1)基态氟原子核外电子的运动状态有____________种,这些电子的电子云形状有___________种;氟原子的外围电子排布式为______________;
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有______ _;与HF2-互为等电子体的分子有________;(举一例).
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为_____________,画出N2F2可能的结构式______________;
(4)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,它属于____________晶体.
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555pm.
①Ca2+、F-的配位数分别为_______和_____;
②列式表示氟化钙晶体的密度______________g•cm-3(不必计算出结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com