
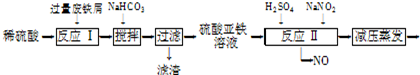
| ||
| 1 |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、次氯酸钙的化学式 CaClO |
| B、次氯酸的电离HClO=H++Cl-+O2- |
| C、硫酸的电离H2SO4=H2++SO42- |
D、镁的原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个N≡N键形成的同时,有NA个H-H键形成 |
| B、NA个N≡N键断裂的同时,有3NA个H-H键断裂 |
| C、NA个N≡N键断裂的同时,有6NA个N-H键断裂 |
| D、NA个N≡N键断裂的同时,有2NA 个N-H键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl、HCl、CO2 |
| B、Ba(OH)2、CH3COOH、NH3?H2O |
| C、NaHCO3、BaSO4、HNO3 |
| D、H2SO4、Fe(OH)3、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、75%(体积分数)的酒精溶液常用于医疗消毒 |
| B、乙烯主要用于作燃料使用 |
| C、石油裂化的主要目的是为了得到轻质油 |
| D、乙酸常用作调味剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com